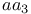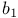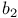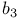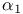Авторизация
Поиск по указателям
Диксон М., Уэбб Э. — Ферменты (Том 3)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Ферменты (Том 3)Авторы: Диксон М., Уэбб Э. Аннотация: Фундаментальная работа по биологии и химии ферментов, написанная крупными английскими биохимиками, отчасти уже известна советскому читателю по переводам двух предыдущих издании (М.: ИЛ, 196) и М.: Мир, 1966). Перевод третьего английского издания выходит в трех томах.
Язык: Рубрика: Биология /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1982Количество страниц: 1120Добавлена в каталог: 29.11.2005Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
Факторы коагуляции 21 22 27 Факторы терминации 865 868—871 Феназины, окисление и восстановление коферментов 671 Фенилаланил-тРНК — синтетаза (6.1.1.20) 793 Фенилаланин — аммиак-лиаза (4.3.1.5) 380 Фенолоксидазы, классификация 313 Феномен «полуцентровой активности» 601 773 Фермент-субстратные промежуточные комплексы 109—111 Фермент-субстратный комплекс 17 Фермент-субстратный комплекс, влияние рН на образование 217—231 Фермент-субстратный комплекс, влияние сродства компонентов на образование 130—133 179—181 Фермент-субстратный комплекс, ионизация 213—235 Фермент-субстратный комплекс, минимальная структура обеспечивающая его образование 386 Фермент-субстратный комплекс, определение понятия 19—20 93—94 219 Фермент-субстратный комплекс, свойства 399—400 Фермент-субстратный комплекс, теория Михаэлиса 92 Ферментативная активность, биологическая регуляция 928—939 Ферментативные реакции, выход продукта 397 Ферменты активные на поверхности раздела между водой и нерастворимым субстратом 122 360 Ферменты с двойной специфичностью 334—335 Ферменты чистые, затруднения, встречающиеся при работе с ними 80—81 Ферменты чистые, определение удельной активности 34 Ферменты чувствительные к низким температурам 240—241 769 Ферменты, активация металлом 560 Ферменты, атомные модели 754—755 758—765 Ферменты, бактериальные загрязнения 29 Ферменты, белковая природа 16 18—19 Ферменты, биологическая регуляция активности 928—939 Ферменты, биосинтез, механизм 858—872 Ферменты, бифункциональные 936—938 Ферменты, взаимодействие с двумя субстратами 123 509—510 Ферменты, взаимодействие с тремя и более субстратами 171—174 Ферменты, влияние изменения фазового состояния растворителя 251 Ферменты, влияние концентрации на скорость реакции 83—92 Ферменты, внутриклеточная локализация 893—894 896—903 Ферменты, высушивание из замороженного состояния 29 53 Ферменты, гистерезисные 646 Ферменты, две формы 112 252 Ферменты, единицы произвольные 31—33 48 Ферменты, единицы стандартные 31—34 Ферменты, зависимость их набора от возраста 911—914 Ферменты, изменение конформации в области активного центра 399—400 Ферменты, искусственный синтез, необходимые условия 744 Ферменты, как основа жизни 887—891 Ферменты, катализирующие одновременно две реакции, кинетика 114—118 Ферменты, количественные вариации в разных тканях 904—911 Ферменты, кривые насыщения субстратом, анализ 607—609 Ферменты, критерии чистоты 76—80 Ферменты, лабильность 27—28 Ферменты, локализация в клетке 893—903 Ферменты, названия систематические и тривиальные 292—294 Ферменты, названия, данные на основании катализируемых реакций 291—293 Ферменты, номенклатура 291—293 299—309 747 Ферменты, номенклатура, схема нумерации 293—299 Ферменты, образование 742 813—881 890—891 Ферменты, образование, генный контроль 872—874 Ферменты, образование, контролирующая роль индукторов 874—954 Ферменты, образование, контролирующая роль репрессоров 872—881 Ферменты, общие правила работы 27—29 Ферменты, определение понятия 18 Ферменты, открытие 14 Ферменты, очистка древесным углем 61 Ферменты, предковые (родоначальные) 917 Ферменты, происхождение 939—950 Ферменты, происхождение термина 14—15 Ферменты, прочное связывание ингибиторов и субстратов 518—519 656—657 Ферменты, разведение, влияние на кинетику 25 Ферменты, различия в содержании у разных видов 745 904—911 914—924 Ферменты, реакции с участием двух субстратов 124—145 Ферменты, рекомендации Международной комиссии 33—34 48 291—293 Ферменты, рестрикции (3.1.23) 367 Ферменты, содержание в разных тканях 904—911 Ферменты, способ выражения концентрации 48 Ферменты, сродство к реагирующим веществам 34—35 130—133 Ферменты, степень насыщения лигандом 571 Ферменты, структура вторичная 735 736—737 750—752 Ферменты, структура первичная 738—750 Ферменты, структура третичная 733—737 753—768 Ферменты, структура четвертичная 735 768—801 Ферменты, структура, особенности 760—768 Ферменты, структура, способы изображения 754—766 Ферменты, структура, таблица молекулярных масс и числа субъединиц 776—801 Ферменты, теория деформации 399—400 767 Ферменты, условия работы при выделении: холодная комната, холодная баня 27—28 Ферменты, условия работы при определении активности 26 36 Ферменты, хранение 29 Ферредоксин 413 903 Ферредоксин-NADP+-редуктаза (1.6.7.1) 33 Ферритин, использование в электронной микроскопии 894 Феррицианид, восстановление, манометрический метод контроля 41 Феррицианид, восстановление, спектрофотометрический метод контроля 37 Феррицианид, как окислитель 349 683 731 Феррохелатаза (4.99.1.1) 327 Фильтрующие средства 29 58 Фиске — Суббароу метод определения фосфатов 43 Фицин (3.4.22.3) 86 274 446 131 Флавинадениндинуклеотид (FAD) диссоциация флавопротеидов 647—648 Флавинадениндинуклеотид, скорость соединения с апоферментом 646—649 Флавинадениндинуклеотид, скорость соединения с белком 24—25 Флавинадениндинуклеотид, структура и свойства 38 40 677—682 Флавинмононуклеотид см. «Рибофлавинфосфат» Флавиновые простетические группы, способ действия 677—683 Флавиновые простетические группы, число на молекулу 682 Флавины и флавопротеиды, окисление и восстановление 411 677 Флавины и флавопротеиды, поглощение света 678 Флавины и флавопротеиды, флуоресценция 40 677 Флавины, образование семихинонов 411 680—684 Флаводоксин, реакция с 413 Флавопротеидзависимая монооксигеназа (1.14.14.1); см. «Цитохром Р-450» Флавопротеидные ферменты, специфичность 349 679—684 Флавопротеиды в гидроксилазных системах 710 Флавопротеиды свойства, определяемые белковой частью 679 680 682 Флавопротеиды, диссоциация 679 Флавопротеиды, механизм восстановления 678 Флавопротеиды, перенос водорода 778 680 683 Флавопротеиды, соединение с атомами металлов 679—684 Флуоресценция флавинов и коферментов 40 178 679 Флуоресценция, измерение при определении ферментов 40 Фолиевая кислота, ее производные как коферменты 724—727 Фолина — Чиокальто метод определения белка 49 Формальдегид, соединение с тетрагидрофолатом 724—727 Формальдегиддегидрогеназа (1.2.1.1) 687 Формиат, взаимодействие с тетрагидрофолатом 725—727 Формилметионин и синтез пептидов у бактерий 742 Формилтетрагидрофолат, структура 724—725 Формилтетрагидрофолат-деформилаза (3.5.1.10) 726—727 Формилтетрагидрофолат-синтетаза (6.3.4.3) 726—727 797 188 Формильная группа, перенос 724—727 Формильные группы в цитохромах a 693 Формиминоглутамат-дезиминаза (3.5.3.13) 787 Формиминотетрагидрофолат-циклодезаминаза (4.3.1.4) 726—727 778 Формимоногруппы, перенос 727 Фосфат как акцептор гликозильных групп 352 355 Фосфат неорганический, колориметрическое определение 43 Фосфат торможение арилсульфатазы 90 Фосфат, перенос 713—715 Фосфат-ацетилтрансфераза (2.3.1.8) 44 315 890 66 Фосфатаза фосфорилазы (3.1.3.17) 781 Фосфатазы, колориметрический метод определения 43 Фосфатазы, реакции и специфичность 322 335 364—365 436—437 458—460 Фосфатидатфосфатаза (3.1.3.4) 909 Фосфатидилинозитол-киназа (2.7.1.67) 908 Фосфатидилхолин 710—711 Фосфо-2-кето-З-дезоксиглюконат — альдолаза (4.1.2.14) 784 Фосфоаденилилсульфатаза (3.6.2.2) 730 Фосфоглицератдегидрогеназа (1.1.1.95) 14 Фосфоглицераткиназа (2.7.2.3) 437 736 780 908 85 Фосфоглицератфосфатаза (3.1.3.20) 793 Фосфоглицератфосфомутаза (5.4.2.1) 321 328 Фосфоглицеромутаза (2.7.5.3) 781 909 91 Фосфоглюкомутаза (2.7.5.1) 345 429 782 909 90 Фосфоглюкомутаза, катализируемые реакции 330 406 663 715 Фосфоглюконатдегидрогеназа (1.1.1.43) 787 Фосфоглюконатдегидрогеназа (декарбоксилирующая) (1.1.1.44) 419 906 8 Фосфоднэстераза I (3.1.4.1) 322 427 Фосфоенолпируват-карбоксикиназа (ATP) Фосфоенолпируват-карбоксикиназа (GTP) (4.1.1.32) 326 910 913 Фосфоенолпируват-карбоксикиназа (фосфат) (4.1.1.38) 326 158 Фосфоенолпируват-карбоксилаза (4.1.1.31) 326 406 795 899 Фосфолипаза (1.1.1.4) 736 778 95 Фосфолипазы, специфичность 335 Фосфолипиды во внутриклеточных частицах 699 Фосфомутазы (2.7.5 и 5.4.2) 320—321 Фосфомутазы, коферменты 715 Фосфопантетеин 721 Фосфопротеидфосфатаза (3.1.3.16) 909 Фосфорибозилглицинамид — синтетаза (6.3.4.13) 475—476 781 Фосфорибозилформилглицинамидин — синтетаза (6.3.5.3) 790 Фосфорилаза (2.4.1.1) 315—316 352 427 432—435 604 610 615 646 720 774 794 907 923 931—932 68 Фосфорилазы, колориметрический способ определения 43 Фосфорилазы,специфичность 315—316 352—355 427 Фосфорилирование окислительное 706 888—889 Фосфорилирование окислительное, механизм 888—889 Фосфосеринфосфатаза (3.1.3.3) 914 Фосфотрансферазы (2.7) 306 319—321 337 355—359 713—715 889—890 Фосфотрансферазы, специфичность 355—359 Фотомаркировка 404 Фотосинтез, участие цитохромов 632 697—698 Фотосинтезирующие граны 896 903 Фотохимический спектр 707—708 Фракционирование внутриклеточных компонентов 894—899 Фракционирование при очистке ферментов 54—74 Фруктозо-1,6-бисфосфат, влияние на образование комплекса альдолазы с F-актином 774 Фруктозо-бисфосфатаза (3.1.3.11) 46 177 437 460 622—623 789 909 100 Фруктозобисфосфат-альдолаза (4.1.2.13) 39 90 326 377 467 768 785 774 897 910 915 924 163 Фруктокиназа (2.7.1.4) 357 Фторид 871 Фузидиевая кислота 871 Фумарат-гидратаза (4.2.1.2) 112 460—462 749 910 921 171 Фумарат-гидратаза, активация анионами 197 565—566 569 Фумарат-гидратаза, действие температуры 251—259 Фумарат-гидратаза, ионизация групп 218 Фумарат-гидратаза, катализируемые реакции 327 Фумарат-гидратаза, конкурентные ингибиторы 529—530 Фумарат-гидратаза, спектрофотометрические методы определения 37 84 Фумарат-гидратаза, специфичность 377—378 Хаотропные агенты, использование для экстрагирования ферментов 53 Хартриджа — Роутона проточный метод 261 Хемиосмотическая теория 706 888—889 Химозин (3.4.23.4) 777 135 Химопапаин (3.4.22.6) 777 Химотрипсин (3.4.21.1) 733 777 121—124 Химотрипсин, ингибирование 281 543—544 Химотрипсин, кинетика действия 230 235 257 274 510 Химотрипсин, механизм действия 180 265 281 441—446 Химотрипсин, специфичность 337—340 359 373 Химотрипсин, структура 737 741 748—749 754—758 Химотрипсиноген, активация 741 Хинолины, окисление 335 Хинонредуктаза 349 Хиноны как акцепторы водорода 349 672 Хиноны как переносчики водорода 689—692 Хлорамфеникол 871 Хлорид, активация 564—566 Хлорид, активация арилсульфатазы 567 Хлорид, ингибирование фумаратгидратазы 565—566 Хлоридпероксидаза (1.11.1.10) 46 Хлорин в молекуле цитохромов d 694 Хлоропласты, локализация в цитоплазме 891 Хлоропласты, содержание цитохромов 903 Хлоропласты, структура 896 903 Хлоропласты, ферменты 903 Хлороформ, денатурация белков 75 Хлортетрациклин 871 Холдейна соотношения 111—112 162—163 256 Холинэстераза (3.1.1.8) 441 446 909 Холинэстеразы, 218—219 Холинэстеразы, ингибирование 439—442 483 Холинэстеразы, манометрический метод определения 41 Холинэстеразы, специфичность 363—364 Холинэстеразы, типы 363—364 Хоризматмутаза (5.4.99.5) 936—939 Хоризматсинтаза (4.6.1.4) 936 Хроматографические методы разделения ферментов 44 63—67 Хроматография аффинная на агарозе 65 66 Хроматография на полиакриламидных гелях 66—67 Хроматография на сефарозе 66 Хроматофоры у фотосинтезирующих бактерий 892 Хромосомы, структуры 892—893 Целлюлаза (3.2.1.4) 776 109 Целлюлоза и ее производные в хроматографии 64—65 Центрифуга с охлаждением 29 Центрифуга, разделение субклеточных частиц 894—895 Центрифугирование в градиенте плотности 77 893 895 Центрифугирование дифференциальное 894 Центросома 891 Цепи полипептидные, влияние их длины на специфичность 350 360—364 371—372 376 377 382—385 Цепи реакций 45 707—708 Цефалоспориназа (3.5.2.6) 147 Цианид, активация некоторых протеиназ 86 Цианид, как ингибитор фермента 481 483 529 696 707 713 Цигохромпероксидаза (1.11.1.5) 778 40 Цикл мочевины, локализация ферментов 900 Циклический AMP 829 879 931—932 Циклогексимид 871 Циклодекстрин-глюканотрансфераза (2.4.1.19) 316 Цинк в ферментах 448 459 463—464 670 756—763 Цинка гидроокись, фракционирование ферментов 62 цис-транс-Изомеразы (5.2) цис-транс-Изомеразы, специфичность 328 340—341 466 Цистатионин- (4.2.1.22) 327 797 Цистатионин- (4.4.1.1) 177 Цистатионин- (4.2.99.9) 793 (см. Цистеамин-диоксигеназа (1.13.11.19) 787 Цистеин в активных центрах ферментов 324 422—423 446 Цистеин-диоксигеназа (1.13.11.20) 907 Цистеинсинтаза (4.2.99.8) 774 783 798 Цистроны 832 Цитоплазма, структуры 625 Цитохром 696—707 Цитохром 696 Цитохром (1.1.2.3) 696 Цитохром 696 Цитохром 672 697 708 709 899 903 Цитохром 697 Цитохром 697 Цитохром 697 Цитохром 697 Цитохром 698 Цитохром 698 Цитохром 696 Цитохром b 692 696 708 Цитохром c, видовые различия 699—700 Цитохром c, восстановление 349 671—672 701—703 Цитохром c, как переносчик при дыхании 692—693 697 Цитохром c, кристаллизация 699 Цитохром c, окисление 701 Цитохром c, свойства 37—38 695 699—703 Цитохром c, структура 700 Цитохром c-551 698 Цитохром c-оксидаза (1.9.3.1) 696 704—708 897 907 37 Цитохром c-редуктаза 711 Цитохром d 698 Цитохром P-450 672 697 708—712 899 903 Цитохром с’ 694 698 Цитохром, (1.6.2.2) 419 424 681—682 694 779 Цитохром, биосинтез 704 Цитохром, ингибирование 481 483 Цитохром, катализируемые реакции 629 705—708 Цитохром, механизм действия 704—708
Реклама
 |
|
О проекте
|
|
О проекте



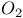
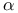 -амилазы
-амилазы 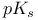 групп
групп 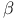 -синтаза
-синтаза  -лиаза
-лиаза