Авторизация
Поиск по указателям
Диксон М., Уэбб Э. — Ферменты (Том 3)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Ферменты (Том 3)Авторы: Диксон М., Уэбб Э. Аннотация: Фундаментальная работа по биологии и химии ферментов, написанная крупными английскими биохимиками, отчасти уже известна советскому читателю по переводам двух предыдущих издании (М.: ИЛ, 196) и М.: Мир, 1966). Перевод третьего английского издания выходит в трех томах.
Язык: Рубрика: Биология /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1982Количество страниц: 1120Добавлена в каталог: 29.11.2005Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
(.1.1.149) 778 (1.1.1.53) 10 (1.1.1.50) 419 780 (2.4.1.64) 799 (3.2.1.22) 368 114 (3.2.1.24) 368 797 909 (3.2.1.55) 674 118 (3.2.1.51) 796 (3.2.1.49) 646 792 (3 2 11) 455 564—566 776 909 104—106 322 368—370 (3.2.1.20) 368 783 749 (3.2.1.23) 368 768 909 115 (3.2.1.31) 796 899 909 911 921 (3.2.1.25) 368 787 (3.2.1.26) 189—190 368 795 (3.2.1.30) 792 909 (3.2.1.52) 674 117 (3.2.1.2) 322 346 368 455 796 107 (1.1.1.51) 419 (3.2.1.21) 368 781. (5.4 3 3) 729 751—752 757—758 759 766—767 (3.5.1.3) 781 909 830 829—830 (Ацил-переносящий белок) –фосфодиэстераза (3.1.4.14) 723 (Ацил-переносящий белок) — малонилтрансфераза (3.3.1.39) 723 (Ацил-переносящий белок) —ацетилтрансфераза (2.3.1.38) 723 1,3-Дифосфо-D-глицерат, образование 888 1,4- (2.4.1.18) 316 1,4-Лактоназа (3.1.1.25) 321 1-D-1 -гуанидино-3-амино-1, 3-дезокси-сцилло-инозитол—аминотрансфераза (3.5.3.7) 793 2,3-Дифосфо-D-глицерат 773 2,5-Дигидроксипиридин — 5,6-диоксигеназа (1.13.11.9) 797 50 2-Изопропилмалат-синтаза (4.1.3.12) 791 2-Оксоглутарат, как кофермент, переносящий аминогруппы 713 720 2-Оксоглутаратдегидрогеназа (липоамид) (1.2.4.2) 686 731 774 3,4-Дигидроксифенилацетат — 2,3-диоксигеназа (1.13.11.15) 669 52 3-Гидроксиантранилат-оксидаза (1.10.3.5) 791 3-Гидроксиацил-CoA — дегидрогеназа (1.1.35) 379 419 6 3-Гидроксибутиратдегидрогеназа (1.1.1.30) 46 898 906 5 3-енол-Пирувоилшикимат-5-фосфат — синтаза (2.5.1.19) 936 3-Оксоацил- (ацил-переносящий белок)-редуктаза (1.1.1.100) 723 3’-Фосфоаденилилсульфат, как предшественник органических сульфатов 321 4- (2.4.1.25) 316 4-Гидрокси-2-оксоглутарат — альдолаза (4.1.3.16) 789 4-Гидроксибензоат — 3-монооксигеназа (1.14.13.2) 783 57 5,10-Метенилтетрагидрофолат — синтетаза (6.3.3.2) 726—727 5-Нуклеотидаза (3.1.3.5) 909 5-Фосфорибозилантранилат-изомераза 936 6-Фосфофруктокиназа (2.7.1.11) 39 87 142 143 591 610 792 908 934 79 ADP как переносчик фосфата 713—715 ADP колориметрический метод определения 43 ADP сродство к магнию 551—552 CoA-трансфераза 3-кетокислот (2.8.3.5) 383 436 D-3-гидроксидеканоил-(ацил-переносящий белок) — дегидратаза (4.2.1.60) 778 D-Аланин — аминотрансфераза (2.6.1.21) 781 D-Аспартатоксидаза (1.4.3.1) 349 681—682 D-лактатдегидрогеназа (1.1.1.28) 336—337 343—344 419 D-лактатдегидрогеназа (цитохром) (1.1.2.4) 681—682 D-Лизин — 5,6-аминомутаза (5.4.3.4) 729 D-пептиды, образование 883—885 D-Сериндегидратаза (4.2.1.14) 780 173 dCMP-дезаминаза (3.5.4.12) 610 789 910 F-Актин, связывание ферментов 774 FAD см. «Флавинадениндинуклеотид» Gal-оперон 873—879 GDP как переносчик (акцептор) фосфата 714 GTP и синтез белка 818—819 862—864 GTP участие в реакциях, катализируемых синтетазами 602—603 722 818—819 L-Арабинозоизомераза (5.3.1.4) 799 181 L-глутамилцистеинсинтетаза (6.3.2.2) 472—473 478 L-Лизин — 6-аминотрансфераза (2.6.1.36) 77 L-Рибулозофосфат — 4-эпимераза (5.1.3.4) 179 L-Сериндегидратаза (3.2.1.13) 783 Lac-оперон 872—874 n-Нитрофенол 90—91 n-Хлормеркурибензоат как ингибитор ферментов 532—533 542—543 n-Хлормеркурибензоат, диссоциация ферментов при его действии 768 NAD (Р)+-нуклеозидаза (3.2.2.6) 436 666—667 NAD (Р)+-трансгидрогеназа (1.6.1.1) 419 907 NAD и NADP, pH-стабильность 672 NAD и NADP, биосинтез 674 NAD и NADP, восстановление 37 414—421 666—669 NAD и NADP, ионизация 668—669 NAD и NADP, история открытия 664 NAD и NADP, номенклатура 668—669 NAD и NADP, распространение 670—672 NAD и NADP, свойства 670—676 NAD и NADP, структура 666 NAD(Р)Н-дегидр6геназа (хинон) (1.6.99.2) 35 NAD+-киназа (2.7.1.23) 319 NAD+-нуклеозидаза (3.2.2.5) 674 778 NAD+-пероксидаза (1.11.1.1) 681—682 NAD-связывающие участки дегидрогеназ 670—671 NADH и NADPH, кофакторы гидроксилаз 709—710 NADH и NADPH, окисление 671—672 NADH и NADPH, окисление феррицианидом 675 NADH и NADPH, флуоресценция 178 NADH и NADPH, формы A и B 417—418 676 NADH, ингибирование алкогольдегидрогеназы 641 NADH, определение сродства к ферментам 131—133 NADH, спектр поглощения 666—667 NADH-дегидрогеназа (1.6.99.3) 907 36 NADH-дегидрогеназа (хинон) (1.6.99.5) 681—682 NADP+, гидролиз 665 672—673 NADP+, З’-аналог 675 NADPH-дегидрогеназа (1.7.99.1) 778 34 NADPH-цитохром — редуктаза (1.6.2.4) 681—682 711 897 899 NMN—аденилилтрансфераза (2.7.7.1) 320 674 897 901 o-Аминофенолоксидаза (1.10.3.4) 668 39 p 203—205 p 216—219 222—224 228—235 pH, влияние на действие ионов, на ферменты 565—566 pH, влияние на денатурацию белков 238—239 pH, влияние на константу Михаэлиса 221—235 pH, влияние на максимальную скорость 200—201 213—221 pH, влияние на окислительно-восстановительные процессы 408—411 pH, влияние на процессы ингибирования 528—529 pH, влияние на скорость ферментативных реакций 199—236 pH, влияние на сродство фермент —ингибитор 221—224 528—529 pH, влияние на стабильность ферментов 200—201 pH, влияние на фермент — субстрат 200—201 213—221 pH, контроль и его значение 10 11 29 pK, значения для групп в белках 233—234 UDPгалактоза-липополисахарид — галактозилтрансфераза (2.4.1.44) 317 UDPглюкоза — 4-эпимераза (5.13.2) 773 785 910 UDPглюкоза-липополисахарид — глюкозилтрансфёраза I (2.4.1.58) 772 Абортивные (тупиковые) комплексы 153—154 168 232 Абсолютная скорость реакции, теория 19 238 243—245 Авидин, ингибитор биотиновых ферментов 716 Автолиз клеток 888 902 Автолиз клеток, освобождение ферментов 53 Агаваин (3.4.99.2) 676 138 Агароза для хроматографии 66 Агликон 368 Агрегация ферментов, искусственная 772 Аденилаткиназа (2.7.4.3) 237 319 429 438 777 88 Аденилатциклаза (4.6.1.1) 897 931 Аденилилсульфатаза (3.6.2.1) 730 Аденилилсульфаткиназа (2.7.1.25) 730 Аденилилсульфатредуктаза (1.8.99.2) 730 Аденилосукцинат-синтетаза (6.3.4 4) 680 189 Аденозилметионин, переносчик метильных групп 314 727 Аденозин-3’, 5’-бисфосфат 730 Аденозингомоцистеин 727 Аденозиндезаминаза (3.5.4.4) 910 Аденозинкиназа (2.7.1.20) 777 Аденозинтрифосфат см «АТР» Аденозинтрифосфатаза (3.6.1 3) 108 240—241 252—253 406 769 798 888—889 897 903 910 Адренодоксин 710 Адренодоксинредуктаза (1.6.7.1) 710 (см. также «Ферредоксин — NADP+ — редуктаза») Адсорбция реактантов ферментами 97 Адсорбция, фракционирование ферментов 61—62 Азид как ингибитор ферментов 529 705 Аконитат спектрофотометрическое определение 27 84 Аконитат-гидратаза (4.2.1.3) 84 327 342 406 910 Активаторная константа 32 546 Активаторы 545—569 Активаторы заменимые 556—559 Активаторы незаменимые 545—556 Активаторы при выделении ферментов 85—86 Активаторы, взаимодействие с субстратом 549 554—559 659—660 Активаторы, ингибирование избытком 553 Активаторы, ионы металлов, кинетика 549 556 Активаторы, металлы 139 545 560—561 Активаторы, определение механизма действия 559—561 Активация ферментами 18—19 399 Активация ферментов субклеточных частиц 898 Активированный комплекс 19 243—245 Активность каталитического центра 33—34 Активность молекулярная 32—34 Активность раствора фермента 48 Активность удельная 32—34 48 Активность фермента, определение 47—49 Активность, единицы 31—34 Актиномицин D как ингибитор синтеза белка 871 Акцепторная специфичность дегидрогеназ 310—312 347—348 414—415 Аланинаминотрансфераза (2.6.1.2) 346 788 908 73 Аланиндегидрогеназа (1.4.1.1) 796 Алкогольдегидрогеназа (1.1.1.1), изоферменты 919 Алкогольдегидрогеназа (NADP+) (1.1.1.2) 347 Алкогольдегидрогеназа, использование для определения фосфатазы 39 Алкогольдегидрогеназа, кинетика действия 133 139 160 163 170 197 275—276 281 569 Алкогольдегидрогеназа, механизм действия 406 415—419 640—641 Алкогольдегидрогеназа,специфичность 335 347 675 918—919 Алкогольдегидрогеназа,стереоспецифичность 344 Алкогольдегидрогеназа,структура 670 736 743 782 1 Аллели 916 922 Аллостерическая константа 582 Аллостерические ингибиторы 570 933—934 Аллостерические эффекты 570—573 Альгинатсинтаза (2.4.1.33) 317 Альдегид-дегидрогеназа (1.2.1.3) 140 347 419 795 Альдегид-дегидрогеназа (NAD(P+) (1.2.1.5) 18 Альдегид-дегидрогеназа (NADP+) (1.2.1.4) 347 Альдегид-лиазы 326 Альдегидные группы, их переносчики 730—731 Альдегидоксидаза (1.2.3.1) 335 Альдегиды соединение с NAD 675 Альдегиды, окисление 39 310—311 335 Альдоза—1-эпимераза (5.1.3.3) 328 381—382 466 781 Альдозоредуктаза (1.1.1.21) 782 Альдолаза (4.1.2.13) 39 90 326 377 467 768 774 785 897 910 915 924 Альтернативные субстраты 157—162 Алюминия гидроокись, приготовление 61 Алюминия гидроокись, фракционирование с ее помощью ферментов 61 Амид-сингетазы 329 Амидаза (3.5.1.4) 383 Амидин-лиазы 327 Амидные группы, образование модифицированных форм ферментов при их потере 924 Амидофосфорибозилтрансфераза (2.4.2.14) 780 Амиды, гидролиз пептидазами 373—374 Амилаза 14 370 Амилазы 27 Амилазы. специфичность 368—369 Амилопектин, синтез 316 Амилопектин, фосфоролиз 352 Амилосахараза (2.4.1.4) 316 Аминоацил-тРНК — гидролаза (3.1.1.29) 673 98 Аминоацилаза (3.5.1.14) 909 Аминогруппы, ионизация 233—235 Аминогруппы, переносчики 717—720 Аминокислотная последовательность ферментов 813—814 Аминокислотные последовательности, гомология 748—750 Аминокислотные последовательности, копирование 813—814 Аминокислоты, замены 744—749 Аминокислоты, механизм окисления 349—350 Аминокислоты, полинуклеотидный код 850—854 941—942 Аминокислоты, последовательность 943—944 Аминокислоты, последовательность в ферментах 733 743 Аминокислоты, последовательность в ферментах, видовые различия 744—745 Аминоксидаза (содержащая медь) (1.4.3.6) 907 29 30 Аминоксидаза (содержащая флавин) (1.4.3.4) 141—143 200 384 514 682 897 907 Аминопептидаза микросомная (3.4.11.2) 798 Аминопептидаза цитозоля (3.4.11.1) 371 797 Аминопептидазы (3.4.11) 371 375—376 Аммиак-лиазы (4.3.1) 327 380 Аммония сульфат, влияние на определение белкового азота 49 Аммония сульфат, фракционирование ферментов 58—61 Аммония сульфат, фракционирование ферментов номограмма 60 Аммония сульфат, «высаливание» 20 АМР-дезаминаза (3.5.4.6) Аналоги NAD и NADP 673 675—676 Анионы как активаторы ферментов 218 564—569 Анри уравнение 106 Антибиотики как ингибиторы биосинтеза белка 871 Антикодоны 817—818 835 840—841 Антимицин A 708 Антитела флуоресцирующие, определение локализации ферментов 894 Антитела, ингибирование ферментов 519 703 711 Антранил-синтаза (4.1.3.27) 791 936 Антранилат-фосфорибозилтрансфераза (2.4.2.18) 936 Апираза (3.6.1.5) 795 Арабинозилолигонуклеотиды, гидролиз 367 Аргиназа (3.5.3.1) 560 788 909 925 148 Аргинин, как репрессор 876 Аргининдекарбоксилаза (4.1.1.19) 801 156 Аргининкиназа (2.7.3.3) 778 87 Аргининосукцинат-лиаза (4.3.2.1) 795 900 Аргининосукцинат-синтетаза (6.3.4.5) 478 900 Аргининрацемаза (5.1.1.9) 178 Ариламин-ацетилтрансфераза (2.3.1.5) 436 Арилациламидаза (3.5.1.13) 383 Арилсульфатаза (3.1.6.1) 38 779 909 Арилсульфатаза, кинетика 86 90 229 567 Арилэстераза (3.1.1.2) 360 909 Ароматические аминокислоты, биосинтез 936—938 Аррениуса графики 241—244 248—255 Аррениуса теория скоростей реакций 19 241—242 Арсенат как акцептор гликозильных групп 352 353 435 Аскорбат 38 688 Аскорбат, как восстановитель 689 713 Аскорбат, окисление 688 710 Аскорбатоксидаза (1.10.3.3) 688 Аспарагин-оксокислота — аминотрансфераза (2.6.1.14) 908 Аспарагиназа (3.5.1.1) 332 790 909 142 Аспарагинсинтетаза (6.3.1.1) 910 Аспартат — карбамоилтрансфераза (2.1.3.2) 181 603 612 616—617 619 768—773 798 907 933 62 Аспартат-4-декарбоксилаза (4.1.1.12) 801 155 Аспартатаминотрансфераза (2.6.1.1) 786 898 908 920 72 Аспартаткиназа (2.7.2.4) 612 788 799 936—938 Аспартат—аммиак-лиаза (4.3.1.1) 84 380 460 463 794 Ассоциативно-диссоциативные модели кооперативности 589—591 АТР, как депо энергии 714 722 818 888—890 АТР, как переносчик фосфата 713—714 АТР, образование 888—889 АТР, роль в процессе образования ферментов 817—819 867—868 АТР, роль в синтезе полипептидов 844 849 867—868 883 АТР, свободная энергия гидролиза 714 818 888 АТР, участие в ферментативных реакциях, колориметрический метод определения 43 АТР, функции 713—714 817—818 888—890 АТР-фосфорибозилтрансфераза (2.4.2.17) 796 АТР-цитрат(про-3S)-лиаза (4.1.3.8) 913 АТРаза (аденозинтрифосфатаза) (3.6.1.3) 108 240—241 252—253 406 769 798 888—889 897 903 910 Ауксотрофные мутанты бактерий 845 Аутокаталитический процесс 24 Аффинная метка 403
Реклама
 |
|
О проекте
|
|
О проекте



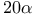 -Гидроксистероид-дегидрогеназа
-Гидроксистероид-дегидрогеназа 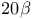 -Гидроксистероид-дегидрогеназа
-Гидроксистероид-дегидрогеназа 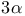 -Гидроксистероид-дегидрогеназа
-Гидроксистероид-дегидрогеназа 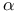 ,
, 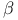 -D-галактозидаза
-D-галактозидаза 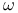 -Амидаза
-Амидаза 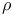 -фактор
-фактор 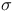 -фактор
-фактор 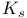 ферментов, значения
ферментов, значения 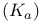 , определение
, определение