Авторизация
Поиск по указателям
Диксон М., Уэбб Э. — Ферменты (Том 3)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Ферменты (Том 3)Авторы: Диксон М., Уэбб Э. Аннотация: Фундаментальная работа по биологии и химии ферментов, написанная крупными английскими биохимиками, отчасти уже известна советскому читателю по переводам двух предыдущих издании (М.: ИЛ, 196) и М.: Мир, 1966). Перевод третьего английского издания выходит в трех томах.
Язык: Рубрика: Биология /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1982Количество страниц: 1120Добавлена в каталог: 29.11.2005Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
Диаминопимелинат-декарбоксилаза (4.1.1.20) 795 Диаминопимелинат-эпимераза (5.1.1.7) 465—466 Дигидроксиэтилтиаминдифосфат 731 Дигидролипоевая кислота 684—685 Дигидрооротат — оксидаза (1.3.3.1) 419 681—682 Дигидропорфирин (хлорин) в цитохромах 694 Дигидроптеридинредуктаза (1.6.99.7) 713 Дигидроурацилдегидрогеназа (1.3.1.1) 906 Диксона график для определения 350 365—368 Диксона график для определения 61—63 124—126 Дикумарин 692 Диметилтетингомоцистеин —метилтрансфераза (2.1.1.3) 350—351 907 Динуклеотиды, образование 320 Диоксигеназы 305 312 Дипептидазы (дипептидгидролазы) (3.4.13) 372 Дипептидилпептидаза (3.4.14.1) Дипептиды, действие на них пептидаз 372 Диссоциация ферментов и белков 768—771 Дисульфидные мостики в молекулах ферментов (белков) 739—740 748 Дитионит (гидросульфит), восстановление коферментов 665 676 683 Дитионит, молярное поглощение 38 Дифосфаты, как коферменты фосфомутаз 715 Дифосфопиридиннуклеотид 669 Дифтерийный токсин как ингибитор 611—612 Дихлорофенолиндофенол как акцептор 349 Диэлектрическая постоянная, влияние на 233 Диэтил-n-нитрофенилфосфат (Е 600, параоксон) 440 ДНК см. «Дезоксирибонуклеиновая кислота» ДНК — нуклеотидилтрансфераза (2.7.7.7.) 823—826 Додецилсульфат натрия 770 ДФФ (диизопропилфторфосфат) 360 403 440—441 446 Дыхательная система 707—708 Дыхательная цепь 672 707—708 888—889 Е-ген ДНК 824 Единица фермента 31—33 47 Еноил-CoA — гидратаза (4.2.1.17) 379—380 793 175 Енолаза (4.2.1.11) 37 378 406 460 462—463 785 910 172 Естественный отбор примитивных пептидов 946—949 Железо в металлофлавопротеидах 413 Железо негемовое в митохондриях 691 708 710—713 Железо-серные группы в ферментах 401 Живая клетка как химическая фабрика 814 818—819 Жирные кислоты, метаболизм 721 Жирные кислоты, системы окисления 900 Жировые капли в клетках 891 З-Оксоацил-(ацил-переносящий белок)-синтаза (2.3.1.41) 723 Забуферивание растворов 26 Загрязнение ферментов бактериальное 29 Загрязнение ферментов следами других ферментов 26 331 Загрязнение ферментов субстратом 654 Замораживание для разрушения клеток 52 Зарин 440 Защита ферментов от денатурации 238—240 Защита ферментов от ингибиторов 403 Идентичность ферментов, критерии 222 335 Изоамилаза (3.2.1.68) 119 Изолейцил-тРНК — синтетаза (6.1.1.5) 480 788 Изомеразы (5) 328—329 380—382 465—469 Изомеризация с участием коэнзима 729 Изомеризация фермента, влияние на кинетику 642—651 Изоморфное замещение 734 753 Изопентенилдифосфат — (5.3.3.2) 782 Изопреноидные соединения, биосинтез 317—318 Изотерма адсорбции Ленгмюра 97 Изотопная асимметрия 342 Изотопный обмен, реакции 164—171 667—668 Изотопы, использование при изучении механизма действия ферментов 415—437 442—443 450 459 461—462 470—475 667—668 732 Изотопы, использование при изучении синтеза и распада белков 925 Изоферменты 676 898 916—924 Изоферменты митохондрий 922 Изоферменты, вероятные функции 918—922 Изоферменты, возможные причины образования 747—748 Изоферменты, классификация 916 Изоферменты, природа 916 Изоферменты, электрофоретическое разделение 78 Изоцитрат-лиаза (4.1.3.1) 793 166 Изоцитратдегидрогеназа (NAD+) (1.1.1.41) 610—611 773 798 906 Изоцитратдегидрогеназа (NADP+) (1.1.1.42) 782 906 920 Изоцитратдегидрогеназа, ингибиторы 196 Изоцитратдегидрогеназа, использование для определения аконитатгидратазы 39 Изоцитратдегидрогеназа, механизм действия 419 422 Изоцитратдегидрогеназа, очистка 50—51 Изоэлектрическое фокусирование 70—71 78 Имидазолацетат — 4-монооксигеназа (1.14.13.5) 58 Имидазолглицеролфосфат-дегидратаза (4.2.1.19) 792 Иминокислоты, образование из аминокислот 310 Иммунологическое изучение деградации ферментов 927 Иммунологическое изучение рибосом 857 Инактивация ферментов кислотами или щелочами 28 Инактивация ферментов на поверхностях 28 Инактивация ферментов органическими растворителями 28 Инактивация ферментов под влиянием низких температур 240—241 Инактивация ферментов при высушивании 29 Инактивация ферментов тепловая 236—241 Инактивация ферментов тепловая, влияние рН 238—239 Инверсия оптическая при ферментативных реакциях 352 368 Ингибирование 481—545 Ингибирование бесконкурентное 154—155 193 483 493—497 Ингибирование бесконкурентное высокими концентрациями субстрата 195—196 Ингибирование двумя - молекулами ингибитора, влияние на связывание 515—518 534—537 Ингибирование избытком активатора 553 Ингибирование избытком субстрата 184—197 Ингибирование избытком фермента 80 89—91 Ингибирование образованием тупиковых комплексов 153—157 167—169 Ингибирование по принципу обратной связи 616 649 653 Ингибирование последовательное 935—937 Ингибирование продуктом 145—153 Ингибирование смешанного конкурентного и неконкурентного типа 483 491—493 497—501 503 506—507 Ингибирование, метод смешанных субстратов 114—118 334—335 Ингибирование, типы 482—483 514—515 Ингибиторная константа, влияние рН 221—225 528—530 Ингибиторная константа, графическое определение 90—91 486—487 497—510 Ингибиторная константа, определение понятия 35 483—484 Ингибиторные константы, величины 337 518—519 528—530 Ингибиторсвязывающие группы, идентификация 534—545 Ингибиторы 481—545 Ингибиторы аллостерические 485 Ингибиторы бесконкурентные 493—497 Ингибиторы биосинтеза белка 870—871 Ингибиторы в препарате субстрата 510—514 Ингибиторы в препарате фермента 90—91 Ингибиторы конкурентные, неконкурентные и бесконкурентные 154—165 483—485 487 Ингибиторы обратимые и необратимые 482—489 530—545 Ингибиторы окислительного фосфорилирования 518—519 Ингибиторы полностью бесконкурентные, кинетика 495—497 Ингибиторы полностью конкурентные, кинетика 483—485 Ингибиторы полностью неконкурентные, кинетика 488—490 Ингибиторы с очень высоким сродством к ферменту, кинетика 518—528 656—657 Ингибиторы смешанного конкурентного и неконкурентного типа 491—493 497—501 503 506—507 Ингибиторы соединенные с субстратом или с активатором 514—515 Ингибиторы частично бесконкурентные, кинетика 495—497 Ингибиторы частично конкурентные, кинетика 485—487 Ингибиторы частично неконкурентные, кинетика 490—491 Ингибиторы частичные 508—509 Ингибиторы, действие при связывании двух молекул 515—518 534—543 Ингибиторы, определение понятия 20—21 483—485 Ингибиторы, применение 481—482 Ингибиторы, применение при изучении специфичности (изостерические) 332 Индол-3-глицерофосфат — синтаза (4.1.1.48) 936 159 Индофенол, как акцептор водорода 349 731 Индукторы, природа 612—613 Индукция образования ферментов 874—875 Индукция, как освобождение от репрессии 874—875 Индуцированное соответствие между ферментом и субстратом 344—347 399—400 542—543 767 Инициатор 831 Инициаторы и затравки в ферментативных реакциях 663 825 Инициация биосинтеза белка (фермента) 860—864 Инозин-нуклеозидаза (3.2.2.2) 367—368 Инсектициды, как ингибиторы ферментов 481 Инсулин, образование 740—741 Инсулин, структура 733 771 Инулосахараза (2.4.1.9) 316 Иодацетамид, как реагент на тиоловые группы 403 Иодацетат, как ингибитор ферментов 542 Ионизация комплекса фермент —субстрат 212—213 Ионизация субстрата 201 221—222 228—229 Ионизация фермента 199—202 212—213 Ионизация фермента, влияние на нее температуры 259 Ионная сила, влияние на денатурацию 239 Ионообменные смолы, разделение ферментов 63—67 Ионы металлов как активаторы ферментов 191—192 406 546 550—556 559—564 622—623 660 679 Ионы, входящие в состав буферных растворов, влияние на активность ферментов 567—569 Ионы, входящие в состав буферных растворов, влияние на зависимость максимальной скорости реакции от рН 567—569 Ионы, входящие в состав буферных растворов, влияние на зависимость эффективной константы Михаэлиса 567—569 Источники ферментов 51—52 Кальций, как активатор фермента 458 Кальция оксалат, гранулы в клетке 891 Кальция фосфат, использование для разделения ферментов 61—63 Кальция фосфат, приготовление геля 61 Камфора — 5-монооксигеназа (1.14.15.1) 712 Карбаматкиназа (2.7.2.2) 780 900 84 Карбамоилфосфат-синтетаза (аммиак) (6.3.4.16) 652 794 910 Карбокси-лиазы (4.1.1) 325—326 Карбоксилазы (6.4) 329 477 Карбоксилэстераза (3.1.1.1) 793 899 909 911 94 Карбоксилэстераза специфичность 336 360—364 383 Карбоксилэстераза, активный центр 360—362 440—442 Карбоксилэстераза, кинетика действия 117 122 184—188 Карбоксилэстераза, механизм действия 440—442 Карбоксиметилцеллюлоза 64 Карбоксипептидаза A (3.4.17.1) Карбоксипептидаза B (3.4.17.2) 742 Карбоксипептидаза, кинетика действия 257 Карбоксипептидаза, образование из предшественника 742 Карбоксипептидаза, специфичность 372 Карбоксипептидаза, структура 345—346 734 737 749—768 Карбонат-дегидратаза (4.2.1.1) 463—464 737 756—757 763 777 910 170 Карбонат-дегидратаза, определение, манометрический метод 40 Карнитин, как переносчик ацильных групп 723—724 Карнитин, проницаемость через мембраны 723—724 Карнитин-ацетилтрансфераза (2.3.1.7) 135 229 545 723 781 65 Каротиноид, синтез 318 Каталаза (1.11.1.6) 32 312 529 796 897 907 924—925 41 Каталитический центр, активность 33—34 Катепсин (3.4.23.5) 781 Катепсины 636 Катехол — 1,2-диоксигеназа (1.13.11.1) 785 Катехол — 2,3-диоксигеназа (1.13.11.2) 791 47 Катехол — метилтрансфераза (2.1.1.6) 907 Кератиназа Streptomyces (3.4.99.11) 139 Кетогексокиназа (2.7.1.3) 357 Кетол-изомеразы, общие представления 467 Киназа фосфорилазы (2.7.1.38) 932—933 Киназы (2.7.1—4) 319 436 Киназы, влияние Mg на равновесие реакции 563—564 Киназы, колориметрические методы определения 43 Киназы, манометрический метод определения 40—41 Киназы, определение 306 713—714 Киназы, специфичность 337 355—359 713 Киназы, участие в переносе энергии 889—890 Кинетика действия ферментов 83—290 Кинетика действия ферментов, выяснение последовательности реакций 142—146 Кинетика действия ферментов, интермедиаты ферментативных реакций 109—111 399—400 Кинетика неупорядоченного равновесного механизма 133—134 144 157—158 162—164 Кинетика неупорядоченного стационарного механизма 135—136 Кинетика предстационарного состояния 260—281 Кинетика при действии двух ферментов на один субстрат 118—119 657—658 Кинетика при упорядоченной системе без образования тройных комплексов 140 144 Кинетика при упорядоченной системе с образованием тройных комплексов 137—138 144 154—155 157—158 162—164 Кинетика реакций с участием двух субстратов 170—171 Кинетика стационарного состояния 95—127 225—226 Кинетика стационарного состояния, общее уравнение 123—127 Кинетические кривые ферментативных реакций 22 83 105—109 Кинетические уравнения 123—126 Кинетический механизм 142—171 Кинетический механизм неупорядоченный, равновесный 134—135 144 Кинетический механизм неупорядоченный, стационарный 135—137 Кислая протеиназа Aspergillus oryzoe (3.4.23.6) 136 Кислая фосфатаза (3.1.3.2) 364—365 427—428 777 897 909 923 Кислород молекулярный, как акцептор водорода 304—305 310 349—350 411—414 691 709 Кислотные ангидриды, гидролиз 324—325 Кислоты и щелочи, техника внесения в ферментные растворы 27 Кислые протеиназы (3.4.23) 323—324 Классификация ферментов 291—329 Клетка 891—903 Клетка, включения в результате фагоцитоза 891 Клетка, структурные компоненты 891 Клеточная мембрана и оболочка 891—892 896—897 Клеточная мембрана, очистка 896—897 Клеточная мембрана, разрушение 52—53 893—894 Клеточная мембрана, синтез полипептидов 882—884 Клеточное дыхание, роль цитохромов 696—713 Кобальт в молекуле кофермента 728—729 Кобальт, как активатор фермента 560—561 Кобамидные коферменты 328 468 728—729 Код генетический 814 819 835—855 Кодоны 814 835—841 941—942 Коллагеназа (3.4.24.3) 788 Колонки хроматографические, методы разделения ферментов 63—67 Колориметрические методы определения белка 49 Комиссия по ферментам Международного биохимического союза 34—35 49 291—293 Компартментация в клетках 903 Комплекс фермент — субстрат 17 Комплекс фермент — субстрат — активатор 197 332—333 398 Комплементарность полинуклеотидных цепей 815—817 821—823 Комплементация межаллельная 771—772 919 Компьютерные программы 522 608 734 753 Компьютерные программы, моделирование быстрых реакций 260—261 270 Компьютерные программы, решение кинетических уравнений 104 127 Конкурентное торможение избытком субстрата 193—195 Конкурентное торможение, взаимодействие субстратов 190—191 Конкурентные ингибиторы, влияние на скорость реакции 482—487 Конкурентные ингибиторы, использование для изучения специфичности ферментов 332 Константа диссоциации комплекса фермент — субстрат 93—94 Константа ионизации групп в белках 233—235 Константа ионизации групп в ферментах 204—205 Константа ионизации групп, определение понятия 207—212 Константа ионизации молекул, определение понятия 207—212 Константа ионизации, определение 216—219 221—225 228—235 Константа равновесия, влияние на нее ионов металлов 561—564 Константа равновесия, выраженная через V и 111—112 161—163 Константа седиментации белков 77 Константа скорости реакции в теории (равновесного) стационарного состояния, определение 276—279 Константа скорости реакции, влияние на нее pH 199—221 Константа скорости реакции, влияние на нее концентрации субстрата 92—198 Константа скорости реакции, влияние на нее температуры 235—258 Константа скорости реакции, зависимость от концентрации фермента 82—92 Константа скорости реакции, как мера удельной активности 32 Контроль биосинтеза ферментов 872—881 924—927 Конфигурация ферментного белка и ее изменение 344—346 399—400 774—775 923 Конфигурация ферментного белка и ее изменение при действии ингибиторов 542—543 Конфигурация ферментного белка и ее изменение при действии кооперативных эффектов 610—613 662 Конфигурация ферментного белка и ее изменение, влияние Ph 234—235 Конформация ферментного белка 923 Концентрация компонентов, определение с помощью графиков 181—184 Концентрирование растворов ферментов, методы 75—76 Кооперативности индекс 605—606 Кооперативность отрицательная 571 601 605 Кооперативность положительная 605 Кооперативность, выбор модели 606—619 Кооперативность, кажущаяся за счет артефактов 651—660 Кооперативность, общая модель 601—602 Кооперативность, способы представления данных 605—606 Кооперативность, феномен «полуцентровой активности» 601 Кооперативность, эффекты изомеризации 642—651 Кооперативность, эффекты скорости 619—642 Кооперативность, эффекты стационарного состояния 625—642 Кооперативные эффекты в каталитических процессах 570—625 662—663 Корниш — Боудена график для определения 507 Кофакторы как переносчики между ферментами 661
Реклама
 |
|
О проекте
|
|
О проекте



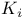
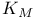
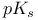
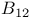
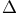 -изомераза
-изомераза 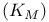 от pH
от pH