Авторизация
Поиск по указателям
Диксон М., Уэбб Э. — Ферменты (Том 3)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Ферменты (Том 3)Авторы: Диксон М., Уэбб Э. Аннотация: Фундаментальная работа по биологии и химии ферментов, написанная крупными английскими биохимиками, отчасти уже известна советскому читателю по переводам двух предыдущих издании (М.: ИЛ, 196) и М.: Мир, 1966). Перевод третьего английского издания выходит в трех томах.
Язык: Рубрика: Биология /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1982Количество страниц: 1120Добавлена в каталог: 29.11.2005Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
Сахароза, гидролиз 251 Сахароза, образование 317 Сахарозосинтаза (2.4.1.13) 317 799 Сахарозофосфорилаза (2.4.1.7) 317 353—354 427 432 434 786 Свет ультрафиолетовый, влияние на биохимические системы 945 Свет циркулярно поляризованный, влияние на фотохимические реакции 945 Свет, вспышка для инициации реакции 264 Свет, диссоциация соединения гем 696 707 709 Свинец, очистка ферментов с помощью солей 75 Свободная энергия гидролиза 623 Свободная энергия образования и распада комплекса ES 241—242 Свободная энергия процесса денатурации 236—238 Свободная энергия процесса инактивации 236—238 Свободная энергия, изменение при ферментативных реакциях 241—242 Свободные радикалы 411—412 729 Секреторные гранулы 891 Секреция, требуемая для нее энергия 887 Семихиноны 411 680—684 Сера, гранулы в клетках 891 Серии, реакция с DFP 403 440—442 Серил-тРНК — синтетаза (6.1.1.11) 787 Серин-ацетилтрансфераза (2.3.1.30) 798 Сериновая эндопептидаза (3.4.21.16) 128 Сериновые протеиназы (3.4.21) 324 440—447 915 Сефадекс, применение 66—67 74 75—76 Сефароза, использование для хроматографии 66 Сиалилтрансфераза (2.4.99.1) 317 Сигмоидные кривые (S-образные) 171 Сигналы старта и терминации синтеза РНК 830—832 852 862 Сиитетазные реакции, механизм 817—818 Силы, действующие при взаимодействии фермента с субстратом 386 398 Симметрические двухосновные кислоты, ионизация 202—207 Симметрические молекулы, стереоспецифичность 340—344 Синтаза полуальдегида тартроновой кислоты (4.1.1.47) 796 Синтазы 325 722 Синтазы, отличие от синтетаз 307—308 325 Синтетазы (лигазы) (6) 293—294 308—309 329 469—480 Синтетазы жирных кислот 774 Синтетазы, колориметрический метод определения 43 Синтетазы, специфичность 335 Синтетазы, участие в биосинтезе 714 715 722 818 883—885 Система глиоксалазная 321 687 Система ферментов гликолиза 321 687 Сквален-монооксигеназа (2,3-эпоксидирующая) (1.14.99.7) 779 Скорость реакции максимальная в теории Михаэлиса 94—95 Скорость реакции максимальная, влияние температуры 246—257 Скорость реакции максимальная, графическое определение 98—104 Скорость реакции на лимитирующей стадии, влияние на нее рН 231—232 Скорость реакции начальная, значение определения 22—24 89—91 Скорость реакции относительная, определение 97—98 Скорость реакции, измерение 22—27 Скэтчарда график 179 Смешанный тип ингибирования 482 491—493 497—501 503 506—507 Смолы ионообменные, разделение ферментов 63—67 Согласованные кооперативные эффекты 615—617 Сокращения для названий субстратов 300 Сокращения для названий ферментов 299—309 Солевые растворы, растворимость в них белков 59—61 Соли, фракционирование ферментов 58—61 Соответствие между ферментом и субстратом, индуцированное 344—347 399—400 542—543 767 Сорбиновая кислота как субстрат 39 Спарсомицин 871 Спектиномицин 871 Спектр поглощения CoA 721—722 Спектр поглощения NAD и NADH 666—667 Спектр поглощения NAD и NADH, изменение при их соединении с ферментом 178 Спектр поглощения липоата 685 Спектр поглощения пиридоксальфосфата 719 Спектр поглощения производных тетрагидрофолата 725 Спектр поглощения убихинона 691 Спектр поглощения флавиннуклеотидов 678 Спектр поглощения цитохромов 696—699 708 Спектрофотометр 36—37 Спектрофотометрические методы 36—39 Спектрофотометрические методы изучения механизма ферментативных реакций 404 Спектрофотометрические методы определения белка 50 Спектрофотометрические методы, их ограничения 88 Сперма 918 Специфичность ферментов двойственная 334—336 Специфичность ферментов, анализ методов исследования 45 331—335 Специфичность ферментов, биологическое значение 330 818—819 Специфичность ферментов, ее природа 330—386 398—399 Специфичность ферментов, трудности изучения 331—332 Специфичность флавопротеидов 677—681 Спиральная структура цепи молекулы белка 735 750—751 756 759 762 767 Спиральная структура цепи молекулы нуклеиновой кислоты 817 Спирт, инактивация ферментов 27 Спирт, фракционирование ферментов 27 57 Список обозначений и сокращений 955—960 Сравнительная биохимия ферментов 904—928 Сродство фермента и ингибитора 34—35 335—338 Сродство фермента и кофермента, определение 130—133 Сродство фермента и субстрата 34 97—104 130—133 Стабилизация ферментов кофакторами 662 Стабилизация ферментов солями 29 Стабилизация ферментов субстратами 56 Стабильность ферментов в клетках 813 Старение, модификация ферментов 927—928 Статистические методы определения 104 Стеклянный электрод 41 Стереоспецифичность ферментов 33 344 377—382 462 667 Стероид- (5.3.3.1) 468 779 184 Стероиды, синтез 318 СТР-синтетаза (6.3.4.2) 602—603 608 796 Стрептококковая протеиназа (3.4.22.10) 132 Стрептомицин 871 Структура ферментов 732—801 Структура ферментов первичная, вторичная, третичная и четвертичная 735—736 738—773 Субклеточные частицы, как источники ферментов 51—52 Субклеточные частицы,состав 895—898 Субклеточные частицы,фракционирование 894—897 Субмитохондриальные частицы 895 Субстрат, связывающие группы 398—399 761 763 Субстратная константа, ее зависимость от рН 35 94—97 221—227 Субстраты и их аналоги 22 403 Субстраты концентрация, влияние на скорость 192—199 Субстраты нерастворимые 121—122 Субстраты определение понятия 19 Субстраты связывание с ингибиторами 174—184 514—515 656—657 Субстраты стабилизация фермента 239—231 Субстраты торможение активности фермента их избытком 184—197 Субстраты элюция с их помощью 65 Субстраты, ионизация 201 333 Субстраты, как активаторы фермента 197—199 Субтилизин (3.4.21.14) 441 457 734 737 743 750 754—755 915 127 Субъединицы, агрегация в присутствии кофакторов 662—663 676 718 Субъединицы, активация при ассоциации 86—87 Субъединицы, в ферментах 670—671 735—736 770—801 Субъединицы, молекулярные массы 738—739 776—801 Субъединицы, расположение 670—671 Сукцинатдегидрогеназа (1.3.99.1) 46 681—682 787 906 Сукцинатдегидрогеназа в метаболических системах 311 Сукцинатдегидрогеназа ее ингибирование 482—483 Сукцинатоксидазная система 897 900 Сукцинил-CoA — синтетаза ( (образующая GDP) (6.2.1.4) 784 Сукцинил-CoA-синтетаза ( (образующая ADP) (6.2.1.5) 474 791 Сукцинилгидролипоат, образование 686 888 Сукцинилирование 768 Сульфат — аденилилтрансфераза (2.7.7.4) 320 730 800 Сульфат — аденилилтрансфераза (ADP) (2.7.7.5) 320 730 Сульфид- и сульфотрансферазы (2.8) 320 730 Сульфитоксидаза (1.8.3.1) 897 Сульфитредуктаза (NADPH) (1.8.1.2) 801 Табун 441 Тартратдегидратаза (4.2.1.32) 792 Температура, влияние на константу Михаэлиса 246 248 Температура, влияние на константу скорости реакции 235—258 Температура, влияние на максимальную скорость 248—249 Температура, влияние на образование и распад комплекса ES 241—246 253—256 Температура, влияние на состояние ионизации групп фермента 233—234 259—260 Температура, влияние на состояние ионизации компонентов ферментных систем 249—251 Температура, влияние на спектр поглощения 694 Температура, влияние на ферментативные реакции 235—258 Температура, инактивации 238—241 Температура, образования комплекса ES 241—242 248—249 Температурный коэффициент денатурации 235—239 Температурный коэффициент ферментативных реакций 246—251 Температурный оптимум ферментативных реакций 236 Температурный скачок, метод 282 619—620 Теорелла—Чанса механизм 139 142—144 Тепловая денатурация 238—241 Тепловая денатурация инактивация ферментов 236—242 Тепловая денатурация обратимая 56 239 Тепловая денатурация температурный коэффициент 237—238 Тепловая денатурация фракционирование ферментов 56 237 Тепловая денатурация, стабилизирующий эффект субстрата 56 239 Теплота активации процесса денатурации 238—241 Теплота активации процесса денатурации энтропия 238 257—258 Теплота активации процесса денатурации. свободная энергия 238 Теплота инактивации ферментов 236—242 Теплота ионизации групп в белках 233—234 259—260 Теплота ионизации компонентов ферментных систем 249—251 Термодинамические величины, взаимосвязь между ними 247—248 Термодинамические величины, определение 256—258 Термодинамические параметры инактивации ферментов 236—241 Термодинамические параметры ферментативных реакций 241—258 Термостабильность ферментов 56 237 Терпеноиды и их синтез 317—318 Тесты на активность фермента 36—44 46 Тетрагидроксиптеридин-циклоизомераза (5.5.1.3) 329 Тетрагидроптеридиновые кофакторы 710 712—713 Тетрагидроптероилглутамат — метилтрансфераза (2.1.1.13) 729 Тетрагидроптероилтриглутамат — метилтрансфераза (2.1.1.14) 60 Тетрагидрофолат 314 724—727 Тетрагидрофолатдегидрогеназа (1.5.1.3) 725 777 Тиаминаза (3.5.99.2) 150 Тиаминдифосфат и его действие 325 686 Тиаминдифосфат, структура и свойства 730—731 Тизелиуса аппарат для электрофореза 67—68 Тилакоиды, мембраны 903 Тимидинкиназа (2.7.1.21) 781 Тимидинфосфорилаза (2.4.2.4) 908 Тиогликозидаза (3.2.3.1) 322 792 Тиоловые протеиназы (3.4.22) 324 446—447 Тиоловые соединения, активация протеиназ 86 Тиоредоксинредуктаза (NADPH) (1.6.4.5) 783 916 Тиосульфат-сульфидтрансфераза (2.8.1.1) 321 634 778 898 909 93 Тиоцианат. как ингибитор ферментов 259 Тиоэфирная связь, превращение ее энергии в энергию фосфатной связи 888 Тиоэфирные связи, значение в обмене ацильных групп 314 Тиоэфирные связи, образование 314 721—722 Тиоэфирные связи, свободная энергия гидролиза 888 Тиоэфиры, гидролиз (3.1.2) 321 Типы обмена 141—171 Типы обратимого ингибирования 482—483 Тираминоксидаза (1.4.3.9) 31 Тирозил-тРНК — синтетаза (6.1.1.1) 737 786 Тирозин — фенол-лиаза (4.1.99.2) 169 Тирозинаминотрансфераза (2.6.1.5) 788 925 936 Тироксин, влияние .на содержание ферментов 914 Тироцидин, биосинтез 884—885 Ткани, различное содержание в них ферментов 52 376 904—928 ТМР-киназа (2.7.4.9) 909 Токсин дифтерийный, ингибитор 870—871 Торможение конкурентное, взаимодействие субстратов 190—192 Торможение конкурентное,избытком субстрата 191 193—195 Трансальдолаза (2.2.1.2) 314 352 783 Трансаминазы (2.6.1) 318 717—720 Транскетолаза (2.2.1.1) 314 351 430 788 907 64 Транскриптаза обратная 826 Транскрипция ДНК 821—835 Транслокация рибосом 861 865—867 Транспептидация 376 Транспорт карбоксильного аниона 900 Транспортная РНК см. «тРНК» Трансферазные реакции 127 Трансферазы 313—321 424—439 Трансферазы внутримолекулярные 328 468 Трансфосфорилирование 319—320 Треониндегидратаза (4.2.1.16) 658 793 174 Третичная структура ферментов 735 753—768 Третичная структура ферментов, способы изображения 755 Трехмерная структура ферментов 733—737 753—769 Триацилглицерол-липаза (3.1.1.3) 932 Триозофосфат-изомераза (5.3.1.1) 467 781 774 910 180 Трипептнд-аминопептидаза (3.4.11.4) 371—372 Трипсин (3.4.21.4) 777 125 Трипсин специфичность 346 374 Трипсин структура 737 748 Трипсин, инактивация и денатурация 237—239 Трипсин, ингибиторы 91 544 Трипсин, кинетика 91 251 259 273 Трипсин, механизм действия 440—441 443—444 Трипсиноген, активация 742 Триптофан как репрессор 876 Триптофан — 2,3-диоксигеназа (1.13.11.11) 379 914 Триптофаназа (4.1.99.1) 795 168 Триптофансинтаза (4.2.1.20) 327 737 791 773 936 тРНК (транспортные РНК) ацилированные 478—480 818 834—849 тРНК и синтез пептидогликана 849 882—884 тРНК изоформы 841—843 879 тРНК, как репрессоры 849 877—879 тРНК, образование 820 834 тРНК, специфичность 818 835—841 тРНК, структура 835—841 тРНК, узнавание синтетазами 845—848 тРНК, функция 817 835 840 Тройной комплекс, механизм 127—128 Тромбин (3.4.21.5) 441 748 778 Тяжелые металлы, использование при определении структуры ферментов 734 753 Тяжелые металлы, использование при очистке ферментов 74 Тяжелые металлы, как ингибиторы ферментов 74 Убихинон, история открытия 690 Убихинон,как переносчик водорода 673 686—691 Убихинон,свойства 690—691 Убихинон,синтез 317—318 Убихинон,структура 690 Углеводы, определение с помощью восстановления меди 43 Углеводы, определение с помощью поляриметрического метода 43 Углекислота, ее переносчики 715—717 Углекислота, измерение 42 262 Углекислота, образование 325—326 Углекислота, фиксация при фотосинтезе 903 Углерод — сера-лиазы (4.4) 327 Удельная активность ферментов, определение понятия 31 48—49 Удельная активность, единицы 31—33 Укладка пептидных цепей в ферментах 733—734 742 744 753—768 Ультразвук, разрушение клеток и частиц 52 699 898 Ультрафильтрация и концентрирование ферментов 76 176 Ультрафиолетовые лучи, влияние на процессы синтеза и распада 945 Ультрацентрифугирование, как тест на гомогенность 77 Ультрацентрифугирование, метод определения молекулярной массы 769—770 Упорядоченное присоединение субстратов 128 Уравнение Анри 106 Уравнение для определения кинетических параметров 93—94 101—103 180—184 203 212—213 550—551 Уравнение Михаэлиса, интегральная форма 105—108 Уратоксидаза (1.7.3.3) 787 897 Уреаза (3.5.1.5) 46 800 144 Уреаза, кинетика действия 252—253 Уреаза, манометрический метод определения 40 Уреаза, первый кристаллический фермент 15 Уреаза, специфичность 376—377 Уридинфосфат (UDP) как переносчик глюкозильных остатков 720—721 Урокиназа 141 Усиление регуляторных сигналов при помощи каскадного механизма 930—934 Установление кинетического механизма 142—171 Фаг 367 830 Фаги MS2, 532—533 Фаги T2, T4, T5 830—831 Факторы инициации 861—864
Реклама
 |
|
О проекте
|
|
О проекте



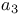 —СО
—СО 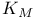
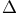 -изокераза
-изокераза 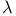
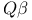 , R17
, R17