Авторизация
Поиск по указателям
Диксон М., Уэбб Э. — Ферменты (Том 3)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Ферменты (Том 3)Авторы: Диксон М., Уэбб Э. Аннотация: Фундаментальная работа по биологии и химии ферментов, написанная крупными английскими биохимиками, отчасти уже известна советскому читателю по переводам двух предыдущих издании (М.: ИЛ, 196) и М.: Мир, 1966). Перевод третьего английского издания выходит в трех томах.
Язык: Рубрика: Биология /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1982Количество страниц: 1120Добавлена в каталог: 29.11.2005Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
Аффинная хроматография 65 Ацетальдегид и его переносчики 731 Ацетил-CoA 721—722 Ацетил-CoA колориметрический метод определения 43—44 Ацетил-CoA — ацетилтрансфераза (2.3.1.9) 793 Ацетил-CoA — синтетаза (6.2.1.1) 477—478 784 Ацетил-АМР как промежуточный продукт 477 Ацетилгидролипоат, образование 686 888 Ацетилсеротонин — метилтрансфераза (2.1.1.4) 785 Ацетилфосфат, определение 43 Ацетилхолин, структура 364 Ацетилхолинэстераза (3.1.1.7) 187 363 797 909 97 Ацетилхолинэстераза, ингибирование 403 493 534 Ацетилхолинэстераза, специфичность 359 363—364 Ацетоацетатдекарбоксилаза (4.1.1.4) 797 154 Ацетоиндегидрогеназа (1.1.1.5) 787 Ацетолактатсинтаза (4.1.3.18) 796 Ацетон, разрушение с его помощью клеток 53 Ацетон, фракционирование с его помощью ферментов 28 57 Ацетоновые порошки, получение из тканей 53 Ацил (ацил-переносящий белок) -фосфолипид — ацилтрансфераза (2.3.1.40) 723 Ацил-CoA — дегидрогеназа (1.3.99.3) 347 384 Ацил-CoA — синтетаза (6.2.1.3) 383 385 Ацил-CoA, образование 329 Ацил-переносящий белок 723 Ацилфосфатаза (3.6.1.7) 776 152 Ацилфосфаты, гидроксиламиновый тест 43 Ацилфосфаты, образование 319 423 888 Ацильные группы 721—723 Базальные тельца ресничек 891 Бактериальная люцифераза 192 Бактерии термофильные, ферменты 237 Бактерии, как источник ферментов 52 Бактериофаги, ДНК 367 Баня с охлаждением 27—28 Белки в органеллах 628 Белки олигомерные, расслабленное и напряженное состояния 582 Белки суммарные, определение 49—50 Белки, биосинтез, значение 813 Белки, биосинтез,механизм 860—872 Белки, расщепление внутриклеточное 887—888 926—927 Белки, расщепление, механизм 323—324 Белки, расщепление, природа ферментов 18—19 750—801 Белок яйца, как причина дефицита биотина в организме 716 Бензальдегиддегидрогеназа (NADP+) (1.2.1.7) 795 Бензоиларгинин- 778 Бетаин-гомоцистеин — метилтрансфераза (2.1.1.5) 351 Бикарбонатный буфер 40 Биология ферментов 887—950 Биолюминесценция 887 890 Биосинтез белков 813—886 Биосинтез нуклеиновых кислот 818—835 Биосинтез ферментов 813—887 Биосинтез ферментов контроль индукторами и репрессорами 872—881 Биосинтез, общие механизмы 714—715 889—890 Биосинтез, энергия 714—715 817—818 887—891 Биотин 715 Биотин, фиксация 329 477 715—717 Биотин-(метил-кротонил-CoA — карбоксилаза) синтетаза (6.3.4.11) 716 Биотин-(метил-малонил-CoA-карбоксилтрансфераза) — синтетаза (6.3.4.9) 716 Биотин-(пропионил-CoA — карбоксилаза (гидролизующая АТР)) — синтетаза (6.3.4.10) 716 Биуретовый метод определения белка 49 Бифункциональные ферменты см. «Ферменты бифункциональные» Богатая энергией связь 883—889 Богатая энергией связь тиоэфирная 315 721—722 888 Богатая энергией связь фосфатная 314—315 319—321 714—715 817—819 888—889 Боргидрид 915 Бриггса — Холдейна теория 95 см.также «Теория стационарного состояния» Брожение как цепь дегидрогеназиых реакций, связанных с коферментами 672 Брожение спиртовое, влияние ингибиторов 482 Бромацетил-CoA 723 Бромацетилкарнитин как ингибитор ферментов 545 Бутанол, экстракция ферментов из субклеточных частиц 53 Бутирил-CoA — дегидрогеназа (1.3.99.2) 384 Быстрые реакции, методы исследования 260—281 Валил-тРНК — синтетаза (6.1.1.9) 788 878 Вандерваальсовы силы 362 376 386 735 761 763 Веретено, структура 893 Взаимодействие субъединиц олигомерного фермента 592—594 Витамин 727 Витамин 728—729 Витамин K, как переносчик водорода 689—692 Витамин K, структура 690 Внутриклеточные структуры 892—896 Внутриклеточные структуры взаимное загрязнение фракций 897 Внутриклеточные структуры, локализация ферментов 896 Внутриклеточные структуры, размер 894—896 Водород переносчики 407—424 664—691 Водород, механизм переноса 407—424 Водородные связи в комплексе фермент—субстрат 386 732 Водородные связи в структуре фермента 735 739 750—752 Водородные связи между полинуклеотидами 815—818 821 834 Водородные связи, разрыв при денатурации 238 Восстановительные эквиваленты 664 669 706 Восстановительные эквиваленты, перенос 407—408 667—668 Восстановление акцепторов водорода, спектрофотометрический метод определения 36—39 Время релаксации 284—290 Вторичная структура ферментов 750—752 Вторичные изоферменты 916 923—924 927 Выпаривание как метод концентрирования ферментов 75 Высушивание из замороженного состояния 75 Высушивание инактивация ферментов 29 53 Галактозид-ацетилтрансфераза (2.3.1.18) 783 67 Галактозооксидаза (1.1.3.9) 779 Галактокиназа (2.7.1.6) 137 169 777 908 Гексозилтрансферазы (2.4.1) Гексозо-1-фосфат — уридилилтрансфераза (2.7.7.12) 785 Гексокиназа (2.7.1.1) 161 170 355—359 429 549 736 768 787 908 78 Гель-фильтрация 54 66—67 177 Гем a 692—693 696—698 704—708 Гемоглобин 573 577 613 750 769—773 Гемоглобин генетический, полиморфизм 922 Гемоглобин, удаление из ферментных препаратов 75 Гемы b, c, d 693 709 Генетический код 818—819 848 941—942 Генетический код и специфичность синтетаз 818—819 845—848 Генные мутации 744—750 Гены в оперонах 829—835 Гены необходимые для непрерывного образования ферментов 813—815 849—851 Гены структурные (цистроны) 831—835 Гены, дупликация 747 Гены, контроль биосинтеза ферментов 872—881 Гены, контроль строения и формы органов и тканей 904 Гены, слияние 773 938—939 Гепарин, влияние на связывание полимеразы промотором 831 Гетеротропный эффект лиганда 571 Гиалуроноглюкозаминидаза (3.2.1.35) 786 Гибель клеток, причины 888 Гибридные механизмы реакций 172 Гидрид-ион в окислительно-восстановительных реактантах 408—411 669 Гидро-лиазы (4.2.1) 327 Гидрогеназа (1.18.3.1) 776 Гидроксаматы, образование из ацилфосфатов 43 Гидроксиацилглутатион-гидролаза («глиоксалаза II») (3.1.2.6) 321 Гидроксилазы (1.99.1) 313 708—712 Гидроксилапатит, получение 63 Гидроксиметилглутарил-CoA — синтаза (4.1.3.5) 141 195 722 Гидроксиметилтетрагидрофолат, образование 726 Гидроксиметилтетрагидрофолат, структура 724 Гидроксипируватредуктаза (1.1.1.81) 12 Гидроксипролин-эпимераза (5.1.1.8) 776 Гидроксиэтилтиаминдифосфат 731 Гидролазы 321 425—426 439—460 Гидролазы эфиров серной кислоты (3.1.6) 730 Гидролазы, наименования 306—307 Гидрофобное ядро ферментов 761 763 Гидрофобные взаимодействия 360 362 376 386 699 735 761 763 Гипоксантинфосфорибозилтрансфераза (2.4.2.8) 784 Гипотеза ключа и замка 15 344—347 399 Гистамин — метилтрансфераза (2.1.1.8) 907 Гистидил-тРНК — синтетаза (6.1.1.21) 877 Гистидин в активных центрах 443—446 456 459 758 Гистидин реакция с иодацетатом 542 Гистидин — аммиак-лиаза (4.3.1.3) 106 221 795 Гистидин, биосинтез 876 938 Гистидиндекарбоксилаза (4.1.1.22) 794 157 Гистидинолдегидрогеназа (1.1.1.23) 786 938 3 Гистидинолфосфат-аминотрансфераза (2.6.1.9) 781 938 Гистоны фосфорилирование 932 Гистоны, их гены в ДНК 880 Гликоген (крахмал)-синтаза (2.4.1.11) 908 913 923 932 Гликоген метаболизм, каскадная регуляция гормонами 936 Гликоген метаболизм, контроль путем фосфорилирования 923 931 933 Гликоген синтез 352 Гликоген фосфоролиз 352 Гликоген, гранулы в клетках 891 Гликогенфосфорилаза ( (2.4.1.1) 315—316 352 427 432—435 603—604 610 615 646 720 774 794 907 923 931 Гликозидгидролазы (3.2) 332 Гликозидгидролазы. специфичность 367—370 Гликозилтрансферазы (2.4) 315—317 Гликозилтрансферазы, специфичность 352—355 Гликозильные группы, механизм переноса 720—721 Гликолиз, влияние ингибиторов 481 Глиоксилатредуктаза (1.1.1.26) 787 Глиоксисомы 902 922 Глицеральдегидфосфатдегидрогеназа (1.2.1.12) 774 792 906 20 Глицеральдегидфосфатдегидрогеназа, видовые различия 745 Глицеральдегидфосфатдегидрогеназа, влияние NAD+ на изомеризацию 649—650 Глицеральдегидфосфатдегидрогеназа, диссоциация 768 770 Глицеральдегидфосфатдегидрогеназа, ингибирование 542—543 Глицеральдегидфосфатдегидрогеназа, механизм действия 418—420 422—423 427—428 620 670—671 Глицеральдегидфосфатдегидрогеназа, реакции 40 178 600 608 Глицеральдегидфосфатдегидрогеназа, структура 671 736 743 745 Глицеральдегидфосфатдегидрогеназа, температурные переходы 649 Глицератдегидрогеназа (1.1.1.29) 419 784 Глицераткиназа (2.7.1.31) 82 Глицерин, асимметрическое фосфорилирование 341 Глицерол-3-фосфат—дегидрогеназа (NAD+) (1.1.1.8) 419 783 906 914 2 Глицерол-3-фосфат—дегидрогеназа (NAD+), использование для определения фосфофруктокиназы 39 Глицеролдегидратаза (4.2.1.30) 729 Глицеролкиназа (2.7.1.30) 337 341 796 908 81 Глицерофосфат-ацилтрансфераза (2.3.1.15) 383 Глицил-тРНК—синтетаза (6.1.1.14) 796 Глицин-формиминотрансфераза (2.1.2.4) 726—727 794 Глицинаминотрансфераза (2.6.1.4) 908 Глициндегидрогеназа (цитохром) (1.4.2.1) 784 Глубокое охлаждение ферментов 29 Глутамат, как переносчик аммиака 318 Глутамат-формилтрансфераза (2.1.2.6) 726—727 Глутамат-формиминотрансфераза (2.1.2.5) 727 Глутаматдегидрогеназа (1.4.1.2) 337 Глутаматдегидрогеназа (NAD(P)+) (1.4.1.3) 419 591 736 769 799 897 906 25 Глутаматдегидрогеназа (NAD(P)+), специфичность 337 Глутаматдегидрогеназа (NADP+) (1.4.1.4) 337 772 Глутаматдекарбоксилаза (4.1.1.15) 240 798 Глутаматсинтаза (NADPH) (1.4.1.13) 928 Глутамил-тРНК—синтетаза (6.1.1.17) 781 Глутамин (аспарагин) аза (3.5.1.38) 769 790 145 Глутамин, как источник азота 928 Глутамин-оксокислота—аминотрансфераза (2.6.1.15) 908 Глутаминаза (3.5.1.2) 143 Глутаминил-тРНК—синтетаза (6.1.1.18) 784 Глутаминсинтетаза (6.3.1.2) 475—476 799 910 928—930 935 187 Глутаминсинтетаза, роль в регуляции метаболизма 928—930 Глутаминсинтетаза—аденилилтрансфераза (2.7.7.42) 930 Глутатион, как кофактор 328 340 466 687 Глутатион, структура и свойства 686—687 Глутатион-гомоцистин—трансгидрогеназа (1.8.4.1) 687 Глутатиондегидрогеназа (аскорбат) (1.8.5.1) 687—688 Глутатионпероксидаза (1.11.1.9) 907 Глутатионредуктаза (NAD(P)H) (1.6.4.2) 419 424 687 779 907 916 Глутатионсинтетаза (6.3.2.3) 474 478 789 Глутатионтрансфераза (2.5.1.18) 633 Глюкагон 914 933 Глюкоза, как общий репрессор 829 879 Глюкозаминат—аммиак-лиаза (4.3.1.9) 719 Глюкозаминфосфат-изомераза (образующая глутамин) (5.3.1.19) 787 Глюкозо-1,6-бисфосфат, как «кофермент» 320 Глюкозо-1-фосфат—уридилилтрансфераза (2.7.7.9) 799 909 92 Глюкозо-6-фосфатаза (3.1.3.9) 458—459 897 899 909 Глюкозо-6-фосфат—дегидрогеназа (1.1.1.49) 419 664 789 906 922 9 Глюкозодегидрогеназа (1.1.1.47) Глюкозодегидрогеназа (акцептор) (1.1.99.10) 786 Глюкозооксидаза (1.1.3.4) 348—349 792 17 Глюкозофосфат-изомераза (5.3.1.9) 467 780 910 183 Глюкокиназа (2.7.1.2) 357 781 908 Гольджи аппарат 891 897 Гомогенность ферментных препаратов, критерии 76—80 Гомогентизат—1,2-диоксигеназа (1.13.11.5) 907 49 Гомология последовательностей 748—749 Гомосериндегидрогеназа (1.1.1.3) 612 790 799 Гомотропный эффект, лиганда 571 Гомоцистеин-метилтрансфераза (2.1.1.10) 794 Гормоны, регуляция уровня ферментов 913—914 931—933 Градиентная элюция 67 Грамицидин, биосинтез 884—886 Граны хлоропластов 903 Графики двойных обратных величин 97—102 129—134 138—141 157—158 175 184—189 192—194 333 Графики двойных обратных величин нелинейные 136—137 142—143 156—157 170—171 193—194 198—199 489—493 505—506 514—521 557—559 572—573 628—629 643—645 652—660 Графики двойных обратных величин, влияние ингибиторов 145—146 496—503 Графики, описываемые уравнением Аррениуса 249—256 Графики, описываемые уравнением Аррениуса для pH-функции в логарифмической форме 222—235 Гуанидиндезаминаза (3.5.4.3) 909 Гуанидинобутираза (3.5.3.7) 793 Гумми (углеводы) дрожжей, влияние на точность определения степени очистки ферментов 49 Давление, влияние на катализируемые ферментами реакции 259—260 Дальциля соотношения 163 Двойной комплекс, определение 127 Двухосновная кислота, ионизация 202—217 Дегидрирование, механизм 407 669—672 Дегидрогеназа D-2-гидроксикислот (1.1.99.6) 681—682 Дегидрогеназные реакции, связанные с коферментами, манометрический метод определения 40—41 Деградация ферментов 924—928 Дезаминазы (3.5.4) 324 Дезоксирибозофосфат-альдолаза (4.1.2.4) 782 161 Дезоксирибонуклеаза I (3.1.21.1) 322 365—367 736 771 101 Дезоксирибонуклеаза II (3.1.22.1) 322 365—367 778 Дезоксирибонуклеиновая кислота (ДНК) 815—817 820 Дезоксирибонуклеиновая кислота митохондрий 920—921 Дезоксирибонуклеиновая кислота митохондрий и синтез изоферментов 920—921 Дезоксирибонуклеиновая кислота митохондрий и функционирование рибосом 869—870 Дезоксирибонуклеиновая кислота митохондрий, функции 920—921 Дезоксирибонуклеиновая кислота, локализация в клетках 901 Дезоксирибонуклеиновая кислота, матрица 820 Дезоксирибонуклеиновая кислота, неповторяющиеся блоки в последовательности 879 Дезоксирибонуклеиновая кислота, повреждения и репарация 823—825 Дезоксирибонуклеиновая кислота, репликация 820—835 Дезоксирибонуклеиновая кислота, роль в синтезе белков и ферментов 814—815 Дезоксихолат, экстракция ферментов 53 708 Дезоксицитидиловые кластеры в ДНК 830—831 Дейтерий, применение при изучении механизма транспорта водорода 415—419 461—463 466—468 667—668 Декарбоксилаза ароматических L-аминокислот (4.1.1.28) 910 Декарбоксилаза диалкиламинокислот (пируват) (4.1.1.64) 326 794 Декарбоксилазы аминокислот 326 718 Декарбоксилазы, классификация 325—326 Декарбоксилазы, манометрические методы определения 40—41 Декстран 353 Декстрансахараза (2.4.1.5) 316 Декстрин-декстраназа (2.4.1.2) 316 Декстрины остаточные, как затравки в реакциях, катализируемых фосфорилазами 353 Декстрины остаточные, как ингибиторы фосфорилаз 353 Денатурация на поверхности 28 Денатурация нагреванием, фракционирование ферментов 56 Денатурация ферментов 27 108 753 Денатурация, теплота инактивации 236—241 Детергенты, использование для экстрагирования ферментов 28 53 699 704 Дефосфо-CoA — киназа (2.7.1.24) 319 Диализ 73—74 Диализ использование трубок для концентрирования растворов 75 Диализ равновесный, определение числа центров связывания 176—177
Реклама
 |
|
О проекте
|
|
О проекте



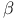 -нафтиламид — аминогидролаза
-нафтиламид — аминогидролаза 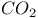
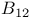 и тетрагидрофолат
и тетрагидрофолат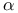 -глюканфосфорилаза)
-глюканфосфорилаза)