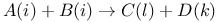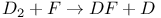Аксиомы (постулаты) химической кинетики 21—23
Активация химическая 147—149
Астрохимия 156—158
Вероятность перехода молекулы из i-го в k-е колебательное состояние 126
Влияние ФРЭЭ на коэффициенты скорости химических реакций 81—85
Влияние химической реакции на равновесную функцию распределения и влияние искажения этой функции на скорость реакции 88—91
Возбуждение колебательных уровней 126—129
Время характерное физических н химических процессов 34
Гипотеза случайных (беспорядочных) фаз 57
Дезактивация молекул соударениями 99—101
Диссоциация молекул 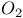 219—224 219—224
Диссоциация термическая 94—97
Диссоциация через пре диссоциирующие уровни 153
Диссоциация через электронно-возбужденные уровни 16 101—106
Диссоциация, коэффициент скорости 77 78
Длина волны де Бройля 11
Закон действующих масс 22
Закон сохранения импульса 21
Закон сохранения масс 20 21
Закон сохранения момента 21
Закон сохранения числа атомов каждого сорта в химически реагирующей системе 20
Закон сохранения энергии 21
Замыкание системы уравнений турбулентных потоков при наличии химических реакций 233—235
Кинетика исторические замечания 27
Кинетика классическая (Аррениусова) 28
Кинетика классическая, ее ограниченность 29
Кинетика неравновесная химическая, гидродинамические проблемы 134—143
Кинетика химическая, общие положения 19—26
Классическая теория, границы применимости для описания взаимодействия атомов и молекул 11 12
Константа скорости химической реакции 30—32
Константа скорости химической реакции, зависимость от температуры 28
Концентрация как обобщенная координата 20
Концентрация, определение 20
Корреляция диссоциации с i-го уровня 77 78
Корреляция пульсаций температуры и концентраций 237—239
Коэффициент в случае максвелл-больцмановского распределения 74 75
Коэффициент восстановления k через 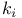 67—70 67—70
Коэффициент для ионизации атомов электронным ударом 76
Коэффициент для ионно-молекулярных реакций 76
Коэффициент при различных температурах реагентов 75 76
Коэффициент скорости химической реакции 65—85
Коэффициент суммарный 65—67
Коэффициент уровневый 65—67
Коэффициент, роль многочастичных взаимодействий и внешних полей 66 67
Максвеллизация газа 78—80 86—88
Максвеллизация ФРЭЭ 83
Метод классических траекторий 171—177
Метод классических траекторий, влияние колебательного состояния молекул 177—180
Метод классических траекторий, детальный анализ реакции 180—182
Метод классических траекторий, исследование реакции обмена 177—180
Метод классических траекторий, исследование реакции рекомбинации 182—185
Метод классических траекторий, исследование стационарного состояния 25 26
Метод классических траекторий, исследование Чепмена — Энскога 56
Метод Монте-Карло 86—91 171—188
Методы расчета динамических и кинетических величин 46 47
Механизм возбуждения молекул CO в тлеющем разряде в 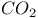 192—196 192—196
Механизм диссоциации 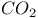 211—217 211—217
Механизм образования возбужденных атомов О в разряде в 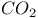 197—210 197—210
Механизм обратных реакций, приводящих к образованию 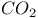 из продуктов рекомбинации атомов O и диссоциации из продуктов рекомбинации атомов O и диссоциации 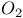 в тлеющем разряде в в тлеющем разряде в 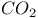 217—219 217—219
Механохимия 160 161
Модели диссоциации 97—99
Модели рекомбинации 108—111
Модели статистического описания химических процессов в условиях турбулентности 230—233
Модель 19
Модель молекулы с степенным законом взаимодействия 9
Модель твердых шаров 9
Модель турбулентного переноса Чанга 139
Независимость статистическая молекул 54 55
Обмен энергией колебательно-колебательный 126—133
Обмен энергией колебательно-поступательный 12 76 77 126—133
Особенности характерные неравновесных реагирующих систем 34—36
Плазмохимия 150—153
Поверхности потенциальные, подбор параметров 185—187
Потенциал Ленарда — Джонса 9
Потенциал модифицированный Букингема 10
Потенциал Морзе 10
Потенциал Штокмайера 10
Потенциалы модельные 8—10
Преобразование Лапласа 72 73
Приближение Линя бимодальное 137—139
Примеси, влияние на химические реакции 99—101
Принцип детального равновесия 40—42
Принцип микроскопической обратимости 40—42
Принцип микроскопической обратимости, квантово-механический вывод 42 43
Принцип Франка — Кондона 10
Процессы излучательные 18
Процессы многоканальные 18
Процессы столкновительные 18
Процессы физико-химические в тлеющем разряде в 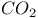 188 188
Равновесие локальное термодинамическое (ЛТР) 22
Равновесие термодинамическое 22 37
Разветвление цепей энергетическое 144—147
Разложение 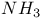 при смешении струй плазмы и реагента 141—143 при смешении струй плазмы и реагента 141—143
| Разложение термическое 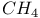 и и 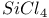 в условиях газового термостата 86—88 в условиях газового термостата 86—88
Распределение Дрювестейна 82
Распределение заселенностей колебательных уровнен состояния 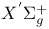 молекулы молекулы 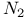 с учетом диссоциации, рекомбинации, диффузии 125—130 с учетом диссоциации, рекомбинации, диффузии 125—130
Распределение Максвелла 74 82
Распределение электронов по энергиям (ФРЭЭ) 81—85
Расстояния межъядерные 173
Реакции O + 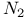 , O + , O + 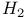 , N + , N + 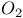 177—179 177—179
Реакции ассоциации возбужденной и невозбужденной молекул 15
Реакции бимолекулярные 58—60 70—73 78—80
Реакции в атмосфере Земли 158
Реакции в неравновесной химической кинетике 14—18
Реакции в сверхзвуковых струях 161
Реакции гетерогенной рекомбинации 18 113 114
Реакции диссоциативного прилипания 16
Реакции диссоциативной электрон-ионной рекомбинации 16
Реакции диссоциации трехатомных молекул 16
Реакции инициируемые горячими атомами 158—160
Реакции мономолекулярные 92—94
Реакции обмена 15
Реакции переноса электронной энергии 14
Реакции под действием лазерного излучения 149 150
Реакции под действием ударных волн 158
Реакции под действием ультразвуковых воли 160 161
Реакции рекомбинации 17 106—108 182—185
Реакции рекомбинации атомов O 219—224
Реакции спонтанной диссоциации 14
Реакции спонтанной изомеризации 14
Реакции ступенчатой диссоциации 16
Реакции тушение соударением без диссоциации 15
Реакции тушение соударением с диссоциацией 15
Реакции тушение соударением с изомеризацией 15
Реакции ударно-радиациониой рекомбинации 17 111—113
Реакции экзотермические 147—149
Реакции эндотермические 147—149
Реакция химическая прямая 48
Реакция химическая, 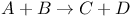 58—60 58—60
Реакция химическая, 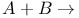 продукты реакции 78—80 продукты реакции 78—80
Реакция химическая, 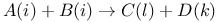 70—73 70—73
Реакция химическая, 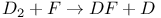 180—182 180—182
Реакция химическая, определение 19
Релаксация диссоциативная 60—62
Релаксация колебательная 116—133
Релаксация реагирующего газа 60—62
Релаксация с учетом диссоциации и рекомбинации 116—133
Сечения 13 14
Сжимаемость локальная и ее вклад в производство турбулентной энергии 235
Система уравнений Паули 126
Система уравнений Паули, численное решение 119—133
Скорость химической реакции, определение 21
Смешение струй реагирующих газов в неравновесной химической кинетике 134—136
Состав равновесный 22
Стадия элементарная химической реакции (элементарный акт) 19
Температура вращательная 5
Температура заселения уровня 5
Температура ионизации 5
Температура колебательная 5
Температура распределения 5
Теория абсолютных скоростей реакций 30
Теория классическая, границы применимости для описания взаимодействия атомов и молекул 11—12
Теория Линденманна — Хиншельвуда 93 94
Теория неравновесная диссоциации - рекомбинации 116—119
Теория рекомбинации Вигнера, Е. и Кекка 108—110
Термодинамика необратимых процессов 36
Термодинамика неравновесная статистическая 36—39
Турбулентный перенос 138—141
Уравнение Аррениуса 28
Уравнение Больцмана (кинетическое) 54—64
Уравнение Лиувилля 39
Уравнение Навье — Стокса 136
Уравнение Паули 48—53 119—133
Уравнение Паули для диссоциации и колебательной релаксации 126
Уравнение Саха 5
Уравнение Фредгольма первого рода 33
Уравнение химической кинетики, общий вид 22 23
Фотохимия 150
Функция Ляпунова 44—46
Функция распределения электронов но энергиям, её влияние на коэффициент скорости химической реакции 81 82 85
Функция распределения электронов по энергиям 81—85
Химия радиационная 154—156
Эволюция макроскопических систем 36—39
Энергия активации 24 25
Энергия вращательная 6
Энергия колебательная 6
Энергия молекулы 6
Энергия наблюдаемая 32 33
Энергия пороговая 24 25
Энергия поступательного движения 6
Энергия электронная 6
Энтропия 43—45
Энтропия в неравновесных системах, определение 43—46
Явления релаксационные, упрощенные выражения для их описания 62—64
«Несмещенность» турбулентных потоков и скорость химической реакции 236—240
«Способность» реакционная 66
|
 |
|
О проекте
|
|
О проекте



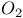
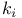
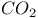
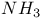 при смешении струй плазмы и реагента
при смешении струй плазмы и реагента 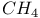 и
и 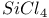 в условиях газового термостата
в условиях газового термостата 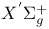 молекулы
молекулы 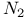 с учетом диссоциации, рекомбинации, диффузии
с учетом диссоциации, рекомбинации, диффузии 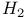 , N +
, N + 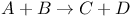
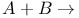 продукты реакции
продукты реакции