Авторизация
Поиск по указателям
Луценко И.Ф. (ред.) — Органические реакции (т. 9)
Обсудите книгу на научном форуме Нашли опечатку?
Название: Органические реакции (т. 9)Автор: Луценко И.Ф. (ред.) Аннотация: Сборник включает семь обзорных статей по различным вопросам органического синтеза.
Язык: Рубрика: Химия /Статус предметного указателя: Готов указатель с номерами страниц ed2k: ed2k stats Год издания: 1959Количество страниц: 614Добавлена в каталог: 18.09.2006Операции: Положить на полку |
Скопировать ссылку для форума | Скопировать ID
Предметный указатель
Бензамид, образование 15 16 17 Бензиламид, образование 17 Бензилиденанилин, реакция с дифенилкетеном 511 Бензилиденанилин, реакция с фталоглицилхлоридом 516 Бензилиденанилин, реакция с этилоным эфиром бромуксусной кислоты и цинком 510 511 Бензилмалоновой кислоты диэтиловый эфир, получение 171 Бензилпенициллин 508 Бензилпенициллиновой кислоты метиловый эфир, обессеривание 522 Бензилпеницилловая кислота 508 Бензилциануксусной кислоты этиловый эфир, получение 136 Бензойной кислоты 2-бромциклогексиловый эфир, получение 477 Бензойной кислоты серебряная соль, реакция с ацетиленовыми соединениями 468 469 Бензойной кислоты серебряная соль, реакция с бромом 448 Бензойных кислот замещенных Ag-соли, получение 470 Бензол в реакции Гаттёрмана 61 Бензол, введение альдегидной группы 55 Бензола полиалкоксипроизводные, введение альдегидной группы 53 54 Бензолсульфонилглицилхлорид, реакция с бензилиденанилином 518 519 Бензофенон, реакция с амидом натрия 8 Бензофураны, введение альдегидной группы 59 Бензо[с]фенантрен-6-карбоновая кислота 549 550. Бензпирен, окисление 94 бис-(2,4-Динитрофенил) ускусной кислоты этиловый эфир 159 Бицикло[3, 3, 1]-ионанон-9-карбоновой кислоты Ag-соль, получение 470 Бицикло[3,3,1]-нонанон-9-карбоновая-1 кислота 456 Винилгалогениды, как алкилирующие агенты 159 Водород цианистый, получение 62 Водорода перекись в реакции Байера — Виллнгера 85 и сл. Водорода перекись, получение 98 Галлацетофенон 51 Галоидоалкилы, как алкилирующие агенты 154 155 Галоиды, реакция с серебряными солями карбоновых кислот 445 и сл. Гаттермана метод синтеза альдегидов 45 и сл. Гаттермана метод синтеза альдегидов, катализаторы 61 Гаттермана метод синтеза альдегидов, механизм реакции 46 47 Гаттермана метод синтеза альдегидов, область применения 47—60 Гаттермана метод синтеза альдегидов, растворители 61 62 Гаттермана — Коха реакция 46 60 Гексадекандиол-1,2, получение 476 477 Гексаметилацетон, расщепление 14 Глутаконовой кислоты эфиры, алкилирование 151 152 Глутаровой кислоты эфиры, алкилирование 151 Гомберга — Бахмана синтез 530 531 Гомберга — Бахмана синтез, механизм 534—536 Гриньяра реактив, присоединение к алкилиденоным производным 162 Дестиобензилпенициллиновой кислоты метиловый эфир, получение 522 Диазониевые соединения, циклизация 529 и сл. Диазония группа замещение на водород 539 540 Диазония группа замещение на галоид 540 Диазония группа замещение на гидроксильную группу 539 Диалкилирование 136—138 Диалкилкарбонаты как алкилирующие агенты 160 Диалкилсульфаты как алкилирующие агенты 160 Диарилкетоны, расщепление 15 16 Дибенз-[aj]-антрацен-6,8-дикарбоновая кислота, получение 550 Дибензоилметана производные, окисление надбензойной кислотой 91 Дибензофуран, образование 54 Дибензофураны, получение 554 555 Дибензо[el]пирен, получение 550 Дигидрофенантрены, получение 553 554 Диизопропилмалоновой кислоты диэтиловый эфир, получение 148 Дикарбэтоксикетон 515 Дифениламинокарбинола натриевая соль, разложение водой 8 Дифениламинокарбинола натриевая соль, термическое разложение 8 Дифенилацетонитрил, алкилирование 131 Дифенилуксусной кислоты метиловый эфир, алкилирование 141 Дифеновая кислота, получение 90 102 Дициннамилиденбиацетил, окисление 91 Диэтилуксусной кислоты этиловый эфир, получение 166 Енолы, введение альдегидной группы 60 Изоандростерона ацетат, окисление 103 Изобутирофенон и получение 20 21 Изобутирофенон и получение амида 22 Изопентилиденмалоновой кислоты диэтиловый эфир, алкилирование 174 Изопеонол 51 Изопропил (формамидо) малоновой кислоты диэтиловый эфир, получение 173 Изопропилмалоновой кислоты диэтиловый эфир, алкилирование 172 Иминоформилкарбиламин, образование 46 Иммония ион 131 Индазол 536 Индазолы, образование 543 и сл. Индолы, введение альдегидной группы 57 58 Йод-трис- (трихлорметилацетат), электропроводность 450 Кали едкое, применение в реакциях алкилирования 135 Калий металлический, применение в реакциих алкилирования 135 Кантарадин, синтез 456 457 Кантариновая кислота 456 457 Карбазолы N-замещенные, получение 554 555 Карбобензоксиглицилхлорид, реакция с бензилиденанилином 518 519 Кетены, взаимодействие с нитрозосоединениями 515 516 Кетены, присоединение к иминам 511—515 Кетоны 89 90 Кетоны алифатические, расщепление 14 15 Кетоны алициклические, окисление 86—88 Кетоны алициклические, расщепление 16 17 Кетоны ароматические, окисление 88 89 Кетоны неенолизирующиеся, расщепление амидом натрия 7 и сл. Кетоны предельные алифатические, окисление 84—86 Кетоны, окисление по методу Байера — Виллигера 82 и сл. Кислоты карбоновые с третичным радикалом, синтез 18 19 Кляйзена конденсация 145 Ксантоны, образование 541 542 Лауриновой кислоты Ag-соль, получение 470 Лептоспермон 92- Лития диэтиламид, применение для алкилирования 135 и сл. м-Нитробифенил, получение 530 Малоновой кислоты эфиры, алкили-рование 147 Малоновый эфир, алкилирование 136 137 139 171 173 Малоновых замещенных кислот эфиры, алкилирование 147—149 Малоновых кислот нитрилы, алкилирование 144 150 151 Мезитилен, окисление 94 Мезитиленкарбоновой кислоты альдегид, получение 62 Мезоксалевой кислоты эфиры, конденсация с ароматическими соединениями 162 163 Метил-н-гексилкетон, окисление 84 85 Метилмалоновой кислоты диэтиловый эфир, образование 146 Метилмасляиой кислоты этиловый эфир, алкилирование 173 174 Метилоктадекандионовой кислоты Ag-соль, получение 470 Метилфлороглюцин, введение альдегидной группы 52 Метилхолантрен, окисление 94 Михаэля реакция 139 140 145 Молекулы с двумя неконденсированными ароматическими ядрами, введение альдегидной группы 54 Моноалкилирование 136 137 Мононадфталевая кислота, получение 99 Мононитрилы, алкилирование 152 153 Морфол 93 94 н-Бутил (изопропил) циануксусной кислоты этиловый эфир, получение 175 н-Бутил- 23 н-Бутилмалоновой кислоты диэтиловый эфир, получение 170 171 н-Бутилциануксусиой кислоты этиловый эфир, алкилирование 175 н-Гексилацетат, получение 85 н-Гептилбромид, получение 471 н-Гептилфенилкетон и получение 22 23 н-Пропилбромид, получение 471 н-Уидецилбромид, получение 472 Надбензойная кислота в реакции Байера — Виллнгера 85 и сл. Надбензойная кислота, получение 99 Надкислоты в реакции Байера — Виллигера 85 и сл. 98 Надсерная кислота в реакции Байера — Виллигера 85 и сл. Надсерная кислота, получение 99 Надуксусная кислота в реакции Байера — Виллигера 88 и сл. Надуксусная кислота, получение 99 100 Натр едкий, применение для алкилирования 135 Натрий металлический, применение для алкилирования 135 Натриймалоновый эфир, алкилирование 1,2-дихлорциклогексаном 158 Натриймалоновый эфир, алкилирование 1-хлор-3-йодпропаном 157 158 Натриймалоновый эфир, алкилирование бромистым этилом 136 Натриймалоновый эфир, алкилирование хлористым бензнлом 171 Натриймалоновый эфир, алкилирование хлористым циклогексилом 158 Натрия амид, применение в реакциях алкилирования 135 Натрия амид, расщепление неенолизирующихся кетонов 7 и сл. Натрия гидрид, применение в реакциях алкилирования 134 и сл. Неофилбромид 447 Нитраты, как алкилирующие агенты 160 Нитрилмалоновой кислоты эфир, алкилирование 148 Оксилизин, синтез 167 Олефинов окиси, как алкилирующие агенты 159 160 Пеларгоновая кислота 90 Пенициллин, изучение строения 513 Пенициллины, 505 Пирокатехин, получение 101 Пиррол-2-альдегид, получение 60 Пирролы, введение альдегидной группы 57—59 Платины окись, применение для восстановительного алкилирования 161 Поликарбонильные соединения, окисление 90—92 Прево реакция 461 463—466 476 477 Прегнадиен-5,6-ол- 90 Прегнандиол- 85 Прегнантрнол-3,16,20, образование 86 Пуберуловая кислота, окисление 91 Пшорра синтез 529 и сл. Пшорра синтез, механизм реакции 530 и сл. Пшорра синтез, область применения 537 и сл. Пшорра синтез, побочные реакции 539 и сл. Пшорра синтез, промежуточные соединения 551— 553 Пшорра синтез, сравнение с синтезом Гомберга — Бахмана 530 531 Пшорра синтез, факторы, влияющие на направление циклизации 547—550 Резорцины, введение альдегидной группы 50 Реймера — Тимана реакция 61 Сарсапогенин, расщепление 86 симм-2-Аминодифенилэтан 539 Симонини комплекс 451 463 468 469 Симонини комплекс термическое расщепление 461 462 Симонини реакция 445 449 450 461 462 463 466 475—477 Симонини сложный эфир 459 Тартроновой кислоты эфиры, конденсация с ароматическими соединениями 162 163 Тетрагидрокарвон, окисление 82 Тетрагидропираниловые эфиры, получение из дигидропирана 166 Тетралин, введение альдегидной группы 55 Тетрахлорэтан в реакции Гаттермана 56 62 Тиазолы, введение альдегидной группы 59 60 Тиобарбитуровые кислоты, синтез 169 Тиофен-2-альдегид, получение 60 Тиофены, введение альдегидной группы 59 60 транс-(2-Оксициклопентил) малоновой кислоты диэтиловый эфир, получение 128 транс-2-Амино- 549 транс-2-Амино- 549 550 транс-2-Амино- 541 транс-2-Амино- 529 транс-2-Амино- 553 транс-2-Амино-3-метил- 548 549 транс-2-Амино-3-метил- 559 560 транс-2-Амино-3-метил-п-(3'-этилфе-нил)коричная кислота 548 549 транс-2-Амино-6-бром-3,4-диметокси- 558 559 транс-2-Нитро- 552 транс-4-Хлор- 560 транс-4-Хлор- 560 561 трео- 141 трет-Бутиламин, образование 20 трет-Бутилмалоновой кислоты диэтиловый эфир, алкилирование 148 трет-Бутиловые эфиры, получение 166 Триазолы, образование 543 и сл. Триацилйодиды, термическое расщепление 463 Триметилуксусной кислоты амид, образование 10 14 15 Трифенилметилнатрий, применение для алкилирования 135 Трифторметилйодид, получение 473 Трифторуксусной кислоты Ag-соль — галоген, как галогенирующий агент 468 Углеводороды ароматические, введение альдегидной группы 55— 57 Ундекафторциклогексанкарбоновой кислоты Ag-соль, получение 471 Фенантрен-9-карбоновая кислота 529 Фенантренхинон, окисление 90 102 Фенантридон, синтезы 543 Фенилацетилкарбамилдиазометан 515 Фенилацетоннтрил, алкилирование 153 175 Фенилацетоннтрил, конденсация с хлористым бензилом 554 Фенилкарбометоксикетен 515 Фенилкетоны алифатические, расщепление 10—14 Фенилкетоны алициклические, расщепление 10—14 Фенилмалоновой кислоты диэтиловый эфир, алкилирование 171 172 Фенилмалоновой кислоты этиловый эфир, декарбокенлирование 143 Фенилуксусной кислоты бензиловый эфир, получение 476 Фенолов двухатомных моноалкильные эфиры, введение альдегидной группы 53 Фенолов одноатомных простые эфиры, введение альдегидной группы 47—49 Фенолы многоатомные, введение альдегидной группы 50—53 Фенолы одноатомные, введение альдегидной группы 49 50 Фенхон 7 16 Фенхон, расщепление 7 Флороглюцин, введение альдегидной группы 52 Флороглюцин-3,5-диальдегид, получение 52 Флуорантены, получение 554 Флуорен 529 Флуорен, реакция с амидом натрия 16 Флуорен-2-альдегид 56 Флуоренон 529 538 556 557 Флуоренон, гетеролитический механизм синтеза 531 Флуоренон, синтез 531 532 533 542 Флуоренон-1-карбоновая кислота 542 Флуоренона перекись 84 Флуореноны, получение 555 556 Формамидомалоновой кислоты диэтиловый эфир, алкилирование 173 Фталимидомалоновой кислоты диэтиловый эфир, алкилирование 149 Фталоилпенициллин, синтез 508 Фталоилпенициллиновая кислота 508 Фураны, введение альдегидной группы 59 Халлера — Бауэра реакция 7 и сл. Халлера — Бауэра реакция, механизм 8 9 Халлера — Бауэра реакция, область применения 9—18 Халлера — Бауэра реакция, экспериментальные условия 20 Хлормалоновой кислоты диэтиловый эфир 146 Хлормалоновой кислоты эфир, алкилирование 148 Хлорметиленформацидин, образование 46 Хризен-5-карбоновая кислота, получение 549 Хризенол-6, получение 551 Хунсдиккера реакция 445 450 452—461 463 466 467 468 471—475 Хунсдиккера реакция, влияние применяемого галоида 459 Хунсдиккера реакция, влияние растворителя 460 461 Хунсдиккера реакция, влияние температуры 460 Циануксусной кислоты этиловый эфир, алкилирование 135 Циануксусной кислоты эфиры, алкилирование 149 150 Циануксусной кислоты эфиры, превращение в мононитрилы 142 Циануксусных замешенных кислот эфиры, алкилирование 150 Циклизация при разложении соли диазония 556—558 Циклоалкилгалогениды, образование из алициклических карбоновых кислот 455 и сл. Циклобутилбромид, получение 474 Циклогексилиден (фенил) ацетонитрил, алкилирование 153 Циклогексилфенилкетон и получение хлористоводородной соли 1-метилциклогексиламина 21 22 Циклогексилфенилкетон, реакция с амидом натрия 14 Циклогексилфенилкетон, реакция с надуксусной кислотой 89 Циклопропилмалоновой кислоты диэтиловый эфир, получение 164 Циклопропилфенилкетон, реакция с амидом натрия 14 Циниолины, образование 543 и сл. Цинк хлористый, как катализатор в синтезе Гаттермана 45 и сл. Цирконий хлористый, как катализатор в синтезе Гаттермана 49 Цирконий цианистый, как катализатор в синтезе Гаттермана 48 49 цис-2-(1'-Нафтил)-1-(2"-аминофенил)-1-фенилэтилен 545 цис-2-Аминостильбен 536 537 539 545 цис-2-Аминостильбен, превращение в фенантрен 539 Цитраль, окисление 93 Щавелевой кислоты диэтиловый эфир, конденсация с эфиром замещенной уксусной кислоты 163 Эпоксипрегнаен-5-ол- 90 эритро- 141 Эритро- 140 Этил (фенил) малоновой кислоты диэтиловый эфир, получение 171 172 Этил(изопропил)малоновой кислоты диэтиловый эфир, получение 172 173 Этил-(1-изопентенил) малоновой кислоты диэтиловый эфир, получение 174 175 Этилмалоновой кислоты диэтиловый эфир, алкилирование 172 Этилмалоновой кислоты диэтиловый эфир, образование 146 Этилфлороглюцин, введение альдегидной группы 52 Этиохолантриол- 102 Янтарной кислоты эфиры, алкилирование 151 «Правило шести» 11
Реклама
 |
|
О проекте
|
|
О проекте



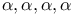 -тетраметилсебациновой кислоты
-тетраметилсебациновой кислоты 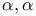 -диметил-
-диметил-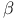 -фенилпропионовой кислоты
-фенилпропионовой кислоты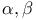 -непредельные, окисление
-непредельные, окисление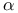 -метил-н-гептилфенилкетон, получение
-метил-н-гептилфенилкетон, получение 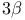 -она-20 ацетат, окисление надбензойной кислотой
-она-20 ацетат, окисление надбензойной кислотой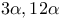 -она-20 диацетат, окисление
-она-20 диацетат, окисление 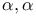 -Дибромянтарной кислоты диметиловый эфир
-Дибромянтарной кислоты диметиловый эфир 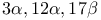 , получение
, получение